微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,该溶液pH一定为14-a
B.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>C(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
参考答案:C
本题解析:
试题分析:A.常温时,某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=a,如为碱溶液,则pH=14-a,故A错误;B.0.1mol/L的KHA溶液,其pH=10,说明HA
本题难度:困难
2、选择题 下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC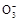 )+c(H+)>c(C
)+c(H+)>c(C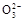 )
)
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S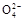 )>c(N
)>c(N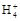 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC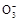 )>c(H+)
)>c(H+)
D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
参考答案:D
本题解析:根据质子守恒有:c(OH-)=c(HC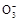 )+c(H+)+2c(H2CO3),A错;B中c(N
)+c(H+)+2c(H2CO3),A错;B中c(N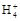 ) >c(S
) >c(S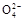 ),B错;C中NaHCO3溶液显碱性,以水解为主,但水解是微弱的,所以c(HC
),B错;C中NaHCO3溶液显碱性,以水解为主,但水解是微弱的,所以c(HC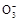 )>c(OH-),C错;D项符合物料守恒,正确。
)>c(OH-),C错;D项符合物料守恒,正确。
本题难度:一般
3、填空题 (共8分)(1)Fe(NO3)3的水溶液呈 ___ (填“酸”、“中”、“碱”)性,原因
是(用离子方程式表示): 。
实验室在配制Fe(NO3)3的溶液时,常将Fe(NO3)3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
参考答案:(1)酸;
本题解析:考查盐类水解的应用。
(1)硝酸铁是强酸弱碱盐,铁离子水解,溶液显酸性,水解方程式是 Fe3+ + 3H2O 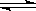 Fe(OH)3 + 3H+;因此在配制硝酸铁溶液时,先将Fe(NO3)3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的就是抑制铁离子水解的。
Fe(OH)3 + 3H+;因此在配制硝酸铁溶液时,先将Fe(NO3)3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的就是抑制铁离子水解的。
(2)硫化钠时强碱弱酸盐,硫离子水解,溶液显碱性。所以在配制硫化钠溶液时,为了防止发生水解,可以加入少量的氢氧化钠固体以抑制硫离子水解。
本题难度:一般
4、选择题 将0.1mol/L NaOH和0.1mol/L NH4Cl溶液等体积混合后,离子浓度大小正确的次序是:
A.C(Na+)>C(CI-)>C(OH-)>C(H+)
B.C(Na+)=C(CI-)>C(OH-)>C(H+)
C.C(Na+)=C(CI-)>C(H+)>C(OH-)
D.C(CI-)>C(Na+)>C(OH-)>C(H+)
参考答案:B
本题解析:由NaOH+NH4Cl=NaCl+NH3.H2O,得:反应后,变为等浓度的NaCl、NH3.H2O 溶液
NaCl=Na++Cl- (完全电离)??? NH3.H2O 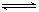 NH4++OH- (部分电离)
NH4++OH- (部分电离)
且溶液呈碱性,所以:C(OH-)>C(H+)
本题难度:简单
5、选择题 下列有关0.1 mol/L NaHCO3溶液中粒子浓度关系式正确的是
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3-)+2c(CO32-) + c(OH-)
参考答案:D
本题解析:
试题分析:
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) 溶液显示碱性,所以氢离子的浓度一定小于氢氧根的浓度;
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)溶液显示碱性,说明碳酸氢根的水解程度大于碳酸氢根的电离程度,所以,碳酸氢根的浓度大于碳酸钙的浓度;
C.c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)是电荷守恒和物料守恒的杂糅,错误;
D.c(Na+)+ c(H+)= c(HCO3-)+2c(CO32-) + c(OH-)是电荷守恒,正确,故选D。
考点:电荷守恒 质子守恒 物料守恒
点评:
1、所谓电荷守恒是指溶液中所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数相等。
2、快速书写质子守恒的方法:
第一步:盯基准物 (若为溶液则包括水)利用电离和水解得到 得质子产物和失质子产物。
第二步:看基准物 、得质子产物和失质子产物相差的质子数
第三步: 列出质子守恒关系式 得质子数=失质子数
第四步:用物料守恒和电荷守恒加以验证
3、物料守恒可以理解为原子守恒的另一种说法。就是说“任一化学反应前后原子种类(指原子核中质子数相等的原子,就是元素守恒)和数量分别保持不变”,可以微观地应用到具体反应方程式,就是左边带电代数和等于右边。其中的也可以理解为原子核,因为外围电子数可能有变,这时候可以结合电荷守恒来判断问题。可以微观地应用到具体反应方程式,就是左边(反应物)元素原子(核)个数种类与总数对应相等于右边(生成物)(当然也不会出现种类不同的情况)。
本题难度:困难