微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 (10分)短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)E在元素周期表中的位置是 。
(2)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物与BA3反应生成B的单质, 写出该反应的化学方式 。
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
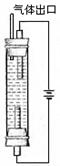
(4)用图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为 ,溶液中出现的现象是 。
参考答案:(1)第三周期第ⅥA族(2)3HClO+2NH3=3HCl+
本题解析:
试题解析:短周期元素A、B、C、D、E、F原子序数依次增大.E与C形成的化合物是大气污染物,容易形成酸雨,E为硫元素、C为氧元素;F元素最高化合价与最低化合价的代数和为6,F处于ⅦA族,则F为Cl元素;A与C可形成A2C2和A2C两种化合物,A处于ⅠA族,D与A位于同一主族,D的原子序数等于氧元素,故A为元素、D为Na元素、A2C2为H2O2、A2C为H2O;B的最高价氧化物对应的水化物甲与气体BH3化合生成离子化合物乙,B为氮元素、甲为硝酸、乙为硝酸铵、BH3为NH3,(1)E为硫元素,原子核外有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族;
(2)由H、O、Cl三种元素按原子个数比1:1:1组成的化合物为HClO,与NH3反应生成氮气,根据电子守恒守恒有HCl生成,同时还生成水,反应方程式为3HClO+2NH3=3HCl+N2+3H2O;(3)常温下,硝酸溶液中水电离的氢离子等于溶液中氢氧根的浓度为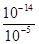 mol/L=10-9mol/L,硝酸铵溶液中氢离子为水电离产生,浓度为10-5mol/L,故由水电离出的
mol/L=10-9mol/L,硝酸铵溶液中氢离子为水电离产生,浓度为10-5mol/L,故由水电离出的 =
=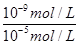 =10-4;硝酸铵溶液中,铵根离子水解,溶液呈酸性,故溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-);(4)用如图所示装置电解由NaCl的饱和溶液时,若阴、阳极都用铁作电极,则阳极Fe放电,生成亚铁离子,阳极的电极反应式为 Fe-2e-=Fe2+,阴极氢离子发生生成氢气,溶液中有氢氧氢氧化钠生成,与亚铁离子反应生成氢氧化亚铁沉淀,故现象为:产生气泡,有白色沉淀生成.
=10-4;硝酸铵溶液中,铵根离子水解,溶液呈酸性,故溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-);(4)用如图所示装置电解由NaCl的饱和溶液时,若阴、阳极都用铁作电极,则阳极Fe放电,生成亚铁离子,阳极的电极反应式为 Fe-2e-=Fe2+,阴极氢离子发生生成氢气,溶液中有氢氧氢氧化钠生成,与亚铁离子反应生成氢氧化亚铁沉淀,故现象为:产生气泡,有白色沉淀生成.
考点:元素周期表和元素周期律;水的电离;电解原理
本题难度:一般
2、选择题 在25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH4HCO3的溶液中,测得其NH4+浓度分别为a、b、c、d(单位为mol/L),下列判断正确的是(相同条件下氨水和醋酸的电离程度相同)
A.a=b=c=d
B.a=c>b=d
C.c>a>d>b
D.c>a>b>d
参考答案:D
本题解析:
本题难度:一般
3、选择题 在1.0 mol·L-1的NH4Cl溶液中,有关离子浓度的关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
参考答案:A
本题解析:
本题难度:一般
4、选择题 设氨水的pH=x,某盐酸的pH=y,已知x+y=14,且x>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
参考答案:C
本题解析:
试题分析:pH之和等于14的酸碱等体积混合,因为氨水是弱碱,继续电离,所以显碱性。
c(NH4+)>c(Cl-)>c(OH-)>c(H+),故选C。
考点:考查酸碱混合离子浓度大小的比较。
点评:pH之和等于14的酸碱等体积混合,谁弱显谁性。属于较简单题。
本题难度:困难
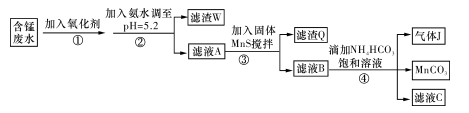
5、填空题 I.利用含锰废水(主要含Mn2+、SO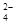 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
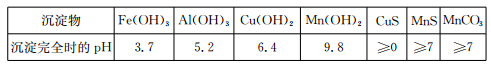
已知某些物质完全沉淀的pH如下表:
回答下列问题:
(1)过程②中,所得滤渣的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表:
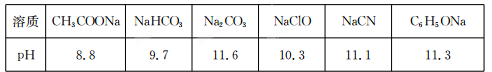
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN B.HC1O C.C6H5OH D.CH3 COOH E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
参考答案:I.(1)Fe(OH)3,Al(OH)3
(2)MnS
本题解析:
试题分析:I.(1)调节pH在5.2,由题意知Fe2+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在;(2)加入MnS是为了使其中Cu2+产生CuS沉淀除去,故搅拌目的是使MnS 与 Cu2+快速、充分反应,离子方程式MnS + Cu2+ = Mn2+ + CuS↓;(3)由题意知Mn2+和加入的HCO3-反应,产生CO2气体和MnCO3沉淀,故离子方程式Mn2++2HCO3- =MnCO3 +CO2↑+H2O;(4)MnCO3受热分解为MnO,MnO部分氧化为MnO2,产品中杂质有MnO,460.0 gMnCO3,物质的量为4mol,受热产生4molMnO,设产生MnO2物质的量为xmol,即有xmolMnO氧化,剩余MnO为(4-x)mol,产物的总质量为(4-x)mol×71g·mol-1+xmol×87g·mol-1=332g,x=3,则MnO2的质量分数=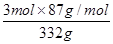 =78.6%。
=78.6%。
II.(1)对应酸的酸性越弱,其阴离子越易水解,其阴离子结合质子能力越强,根据表格中数据可知CO32-结合质子能力最强;(2)对应酸的酸性越弱,其阴离子越易水解,其盐溶液碱性越强,所以PH最小的酸性最强,所以CH3COOH酸性最强,故答案为D;(3)复分解反应中,碱性强的物质置换碱性弱的物质,酸性强的物质置换酸性弱的物质,根据以上知识对各选项进行判断即可;故答案为CD。
考点:考查铁盐和亚铁盐的相互转变;难溶电解质的溶解平衡;离子方程式的书写等。
本题难度:困难