微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 11.2L甲烷、乙烷、HCHO(g)组成的混合气体,完全燃烧后生成15.68L CO2(气体体积均在标准状况下测定),混合气体中甲烷的体积分数可能为
A.20%
B.60%
C.70%
D.80%
参考答案:A
本题解析:分析:根据n=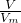 计算混合气体及二氧化碳的物质的量,根据C原子守恒计算混合气体的平均C原子数目,甲烷与甲醛的碳原子数目都是1,可以看做1个组分,将三组分混合物看做2组分混合物,根据平均C原子数目计算乙烷的体积分数,进而计算甲烷与甲醛的体积分数之和,据此解答.
计算混合气体及二氧化碳的物质的量,根据C原子守恒计算混合气体的平均C原子数目,甲烷与甲醛的碳原子数目都是1,可以看做1个组分,将三组分混合物看做2组分混合物,根据平均C原子数目计算乙烷的体积分数,进而计算甲烷与甲醛的体积分数之和,据此解答.
解答:11.2L甲烷、乙烷、HCHO(g)组成的混合气体的物质的量为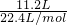 =0.5mol,
=0.5mol,
15.68LCO2的物质的量为 =0.7mol,
=0.7mol,
故混合气体中平均C原子数目为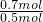 =1.4,
=1.4,
甲烷与甲醛的碳原子数目都是1,可以看做1个组分,将三组混合物看做2组分混合物,
令混合气体中乙烷的物质的量为xmol,甲烷与甲醛的总的物质的量为ymol,则:
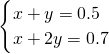
解得:x=0.3,y=0.2,
故乙烷的体积分数为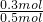 ×100%=60%,
×100%=60%,
甲烷与甲醛的体积分数之和为1-60%=40%,
故选A.
点评:考查混合物的有关计算,难度中等,根据是将将三组分混合物看做2组分混合物,注意平均量的运用.
本题难度:困难
2、选择题 某同学用棉花包裹一种固体,再通过细长玻璃管向棉团缓缓吹气,棉花燃烧起来,则该同学在棉团中包裹的物质是
A.NaClO
B.Na2O2
C.烧碱
D.纯碱
参考答案:B
本题解析:分析:根据Na2O2和CO2反应放热放出热量,生成氧气,达到着火点来分析.
解答:根据Na2O2和CO2反应:2CO2+2Na2O2═2Na2CO3+O2,该反应放热,生成氧气,达到棉团着火点,所以棉团燃烧,
故选B.
点评:本题考查可燃物燃烧的条件、化学方程式的书写、二氧化碳的性质,都属于基础知识,难度不大.
本题难度:困难
3、选择题 2013新交规酒驾处罚规定,车辆驾驶人员血液中的酒精含量大于或者等于20mg/mL、小于80mg/100mL的驾驶行为即为酒驾行为.一种科学简便的检测方法是使驾车人呼出的气体接触载有经过硫酸酸化处理的三氧化铬(CrO3)的硅胶,如果呼出的气体中含有乙醇蒸气,就会发生如下反应:CH3CH2OH+CrO3+H2SO4→CH3CHO+Cr2(SO4)3+H2O(未配平).下列有关说法不正确的是
A.上述反应中三氧化铬(CrO3)是强氧化剂
B.配平上述反应时化学计量数依次为3、2、3、3、1、6
C.当有0.6?mol?CH3CH2OH被还原时,转移电子的总数为1.2?mol
D.由于CrO3与Cr2(SO4)3的颜色不同,可以通过颜色的变化判断驾车人是否饮酒
参考答案:C
本题解析:分析:CH3CH2OH+CrO3+H2SO4→CH3CHO+Cr2(SO4)3+H2O中,Cr由+6价降低为+3价,C由-2价升高为-1价,以此来解答.
解答:A.因Cr元素的化合价降低,则反应中三氧化铬(CrO3)是强氧化剂,故A正确;
B.由电子守恒及原子守恒可知,该反应为3CH3CH2OH+2CrO3+3H2SO4═3CH3CHO+Cr2(SO4)3+6H2O,化学计量数依次为3、2、3、3、1、6,故B正确;
C.当有0.6mol?CH3CH2OH被氧化时,转移电子的总数为0.6mol×2×(2-1)=1.2?mol,故C错误;
D.CrO3与Cr2(SO4)3的颜色不同,利用上述反应可以通过颜色的变化判断驾车人是否饮酒,故D正确;
故选C.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意氧化还原反应中的基本概念,题目难度不大.
本题难度:困难
4、选择题 等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为
A.3∶2
B.2∶4
C.1∶4
D.2∶7
参考答案:D
本题解析:
本题难度:一般
5、选择题 通常情况下溶液中发生的氧化还原反应速率要比复分解反应速率慢,向一定量的Fe、Fe2O3的混合物中,加入足量盐酸,要保证有气体产生,则该混合物中Fe和Fe2O3的物质的量比至少应
A.大于1:1
B.等于1:1
C.小于1:1
D.大于2:1
参考答案:A
本题解析:分析:由题意可知,首先发生反应Fe2O3+6HCl=2FeCl3+3H2O,铁离子氧化性强于氢离子,再发生反应Fe+2Fe3+=3Fe2+,由于有气体生成,故最后发生反应Fe+2HCl=FeCl2+H2↑,说明Fe与Fe3+时Fe有剩余,令化合物中Fe2O3为1mol,据此计算Fe的物质的量取值进行解答.
解答:由题意可知,首先发生反应Fe2O3+6HCl=2FeCl3+3H2O,铁离子氧化性强于氢离子,再发生反应Fe+2Fe3+=3Fe2+,由于有气体生成,故最后发生反应Fe+2HCl=FeCl2+H2↑,说明Fe与Fe3+时Fe有剩余,
令化合物中Fe2O3为1mol,生反应Fe2O3+6HCl=2FeCl3+3H2O后,溶液中n(Fe3+)=2mol,发生反应Fe+2Fe3+=3Fe2+后Fe有剩余,故n(Fe)>1mol,所以混合物中Fe和Fe2O3的物质的量比至少大于1:1,
故选A.
点评:本题考查混合物的有关计算、根据方程式的计算,难度中等,根据题目信息判断发生反应的先后顺序是解题的关键.
本题难度:简单