微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(
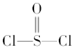
)中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
参考答案:A.锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;<
本题解析:
本题难度:简单
2、填空题 请仔细观察两种电池的构造示意图,回答下列问题:

(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:
????????????????
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析
其原因是?????????????????????????????????????????
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
物质
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
| Mn(OH)2
|
开始沉淀pH
| 2.7
| 7.6
| 5.7
| 8.3
|
完全沉淀pH
| 3.7
| 9.6
| 8.0
| 9.8
?
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2?????????????????。
②第一次加入H2O2后,调节pH=8.0。目的
是?????????????????????????????????????????。
③试列举滤液4的应用实
例????????????????????????????????????????????????????????。
参考答案:1)Zn+2OH--2e-=Zn(OH) 2(2分)。
本题解析:(1)电池负极应为Zn反应;(2)从影响化学反应速率的因素考虑
本题难度:一般
3、实验题 (8分)燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
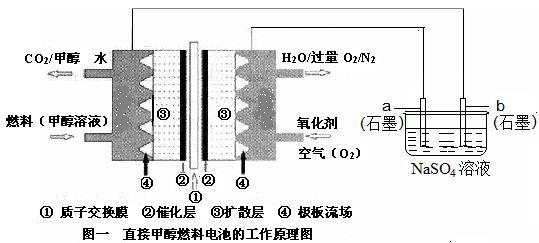
请根据图示回答下列问题: w
(1)图中a电极是????????????(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为?????????。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为??????????????????????????????。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量
是?????? mol。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26 kJ,写出甲醇燃烧的热化学方程式:??????。
参考答案:(8分)(1)阳极?? 4 OH–-4 e–→O2+2H2O
本题解析:略
本题难度:简单
4、选择题 下列说法不正确的是?????????????(???)
A.与铜质水龙头连接处的钢制水管易发生腐蚀
B.把被保护的钢铁设备作为阴极,外加直流电源可进行保护
C.原电池产生电流时,阳离子移向正极,阴离子移向负极
D.铅蓄电池是最常见的二次电池,正极板上覆盖有Pb
参考答案:D
本题解析:A 正确,铜质水龙头和连接处的钢形成原电池,钢做负极,易发生腐蚀。
B 正确,有外接电源,钢管做阴极,不发生腐蚀,被保护了。
C 正确,原电池产生电流时,阳离子移向正极,阴离子移向负极
D 错误,铅蓄电池是最常见的二次电池,负极板上覆盖有Pb
本题难度:一般
5、选择题 电池是人类生产和生活中重要的能量来源。电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锂离子电池已成为笔记本电脑、移动电话等低功耗电器的主流电源
B.氢氧燃料电池可将化学反应的热能直接转变为电能
C.铅蓄电池放电时铅在负极被氧化成二氧化铅
D.锌锰干电池工作一段时间后碳棒变细
参考答案:A
本题解析:原电池是把化学能转化为电能的装置,B不正确。铅蓄电池放电时铅在负极被氧化成硫酸铅,C不正确。锌锰干电池中碳棒是正极,不失去电子,D不正确。所以正确的答案选A。
本题难度:简单
|