微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 36g?H2O与80g?D2O的物质的量之比是_______,分子中所含质子数之比是______,所含中子数之比是______,它们分别与Na反应时,所放出气体体积之比(同条件下)是______,质量之比是______.
参考答案:n(H2O)=36
本题解析:
本题难度:一般
2、选择题 体积相同的NaCl、MgCl2、AlCl3溶液,沉淀其中的Cl-,消耗等物质的量的AgNO3,三种溶液的物质的量浓度之比为( )
A.2∶3∶6
B.1∶2∶3
C.3∶2∶1
D.6∶3∶2
参考答案:D
本题解析:设浓度分别为c1,c2,c3,有c1V×1=c2V×2=c3V×3;可能浓度之比为6:3:2。
本题难度:一般
3、填空题 (9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
① ; ② ;
③ ; ④ 。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。
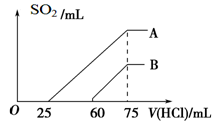
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。
参考答案:(9分)
(1)① KOH、K2SO3&#
本题解析:
试题分析:(1)二氧化硫与氢氧化钾溶液反应时,若二氧化硫少量,与氢氧化钾恰好反应则生成亚硫酸钾,若二氧化硫过量与氢氧化钾恰好完全反应,则生成亚硫酸氢钾,所以二氧化硫与氢氧化钾溶液反应得到的溶液中溶质可能有四种可能:① KOH、K2SO3;②K2SO3;③ K2SO3、KHSO3; ④KHSO3;
(2)①因为亚硫酸根离子与盐酸反应生成亚硫酸氢根离子消耗盐酸的体积与亚硫酸氢根离子生成二氧化硫消耗盐酸的体积相等。A曲线开始无气体产生,且生成气体消耗的盐酸的体积大于无气体产生消耗的盐酸的体积,说明该溶液中的溶质为K2SO3、KHSO3,盐酸先与K2SO3反应生成KHSO3,消耗盐酸25mL,再与亚硫酸氢根离子反应生成二氧化硫共消耗盐酸50mL,所以溶液中K2SO3、KHSO3的物质的量相等,最终得到溶液为氯化钾溶液,设K2SO3、KHSO3的物质的量均是x,则3x=0.075L×0.1mol/L,解得x=0.0025mol,所以产生二氧化硫的体积是2×0.0025mol×22.4L/mol=0.0112L=112mL;
②根据图像中的数据可知,生成气体消耗的盐酸的体积小于无气体产生消耗的盐酸的体积,说明溶液中的溶质为KOH、K2SO3;
③根据A曲线的结果可知K2SO3、KHSO3的物质的量均是0.0025mol,则K元素的物质的量是3×0.0025mol=0.0075mol,所以原KOH溶液的物质的量浓度为0.0075mol/0.05L=0.15mol/L。
考点:考查二氧化硫与氢氧化钾溶液反应的判断,产物的分析,对图像的分析判断及计算
本题难度:一般
4、选择题 一定量的质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质质量分数恰好扩大一倍,体积变为62.5 mL,则浓缩后溶液的物质的量浓度为
A.2.2 mol/L
B.4 mol/L
C.5 mol/L
D.6.25 mol/L
参考答案:B
本题解析:
试题分析:设原溶液的质量为xg ,则14%x=28%(x-50),解得x=100g,则原溶液含溶质的质量为100×14%=14g,物质的量为14g/56g/mol=0.25mol,浓缩后的浓度为0.25mol/0.0625L=4mol/L,答案选B。
考点:物质的量浓度
本题难度:一般
5、选择题 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、C处分别充入等物质的量的X、Y两种气体。当隔板停止滑动时,下列说法正确的是( )
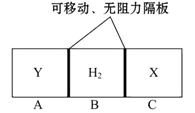
A.气体的体积:V(X) =V(Y)
B.物质的质量:m(X) <m(Y)
C.X的相对分子质量等于Y的相对分子质量
D.X的相对分子质量比Y的相对分子质量小
参考答案:A
本题解析:根据隔板的位置可知三种气体的体积是相同的,A正确;由于气体的摩尔质量不一定相同,所以气体的质量不一定是相同的,B不正确;同样CD不正确,答案选A。
本题难度:一般