微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 往硝酸银、硝酸镁、硝酸铜的混合溶液中加入一定量铁粉,充分反应后,再过滤.下列情况不可能存在的是
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
C.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
D.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
参考答案:A
本题解析:分析:氧化性:Ag+>Cu2+>Fe2+>Mg2+,在金属活动性顺序中,Mg>Fe>Cu>Ag,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中加入一些铁粉,Mg>Fe>Cu>Ag,铁不会与硝酸镁反应,故滤液中一定含有硝酸镁,铁与硝酸银反应生成硝酸亚铁和银,铁与硝酸铜反应生成硝酸亚铁和铜,生成的铜与硝酸银能反应生成硝酸铜和银.
解答:A.在硝酸银与硝酸铜同时存在时,Fe先与硝酸银充分反应后再与硝酸铜反应,当滤纸上有Cu时,说明硝酸银全部参加了反应.因此滤液中一定没有硝酸银,即溶液中一定不存在Ag+,故A错误;
B.当铁粉量不足时,只与部分硝酸银反应,生成银,仍有硝酸银剩余,由于氧化性:Ag+>Cu2+>Fe2+>Mg2+,则滤液中有
Ag+、Cu2+、Fe2+、Mg2+,故B正确;
C.当铁粉适量时,能与混合液中的硝酸银和硝酸铜恰好完全反应,生成Ag和Cu,滤液中有Fe2+、Mg2+,故C正确;
D.当铁粉过量时,与混合液中的硝酸银和硝酸铜完全反应,生成Ag和Cu,Fe有剩余,滤液中有Fe2+、Mg2+,故D正确.
故选A.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义进行,注意离子的氧化性,判断离子反应的先后顺序.
本题难度:一般
2、填空题 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为______________。证明炉渣中含有FeO的实验现象为______________________。
参考答案:(1)Cu、O
(2)b、c
(3)a.Al3+
本题解析:(1)分析方程式中各元素化合价可知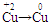 ,
,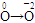 氧元素、铜元素在反应中被还原。(2)二氧化硫污染环境,不能排入空气中,浓硫酸不
氧元素、铜元素在反应中被还原。(2)二氧化硫污染环境,不能排入空气中,浓硫酸不
本题难度:一般
3、填空题 写出下列反应的离子方程式:
(1)Al2O3溶于NaOH溶液:_______________________
(2)Al与NaOH溶液反应:_______________________
参考答案:(1)Al2O3+2OH-==2AlO2-+H2O
(
本题解析:
本题难度:一般
4、填空题 含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式????????????????;
(2)n(Mg2+)/ n(Al3+) =????????;
(3)C1/C2=????????;
(4)所加入NaOH溶液的体积a=???????mL。
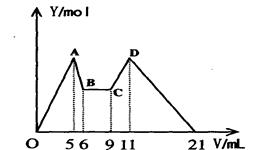
参考答案:(1)H++AlO2-+H2O=Al(OH)3↓
(2
本题解析:
试题分析: O A涉及的化学方程式为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓,
A涉及的化学方程式为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓,
A 本题难度:一般
本题难度:一般
5、计算题 (4分)NaOH、MgCl2、AlCl3的混合物溶于H2O后,加入0.5mol/L的稀盐酸溶液,变化如图,求:
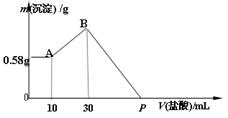
(1)混合物中NaOH的质量是??????g。
(2)P点所表示盐酸加入体积为?????mL。
参考答案:(2分/空,共4分) (1) 2.6 g??(2)130 m
本题解析:略
本题难度:简单