微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
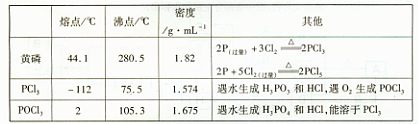
1、实验题 (15分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)
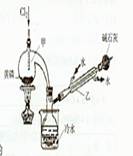
(1)仪器乙的名称??????????????????????;
(2)实验室制备Cl2的离子方程式:???????????????????;
(3)碱石灰的作用是???????????????????,?????????????;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是??????????。
(二)提纯
粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过____(填实验操作名称),即可得到PCl3的纯品。
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出2 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为?????????????(用含字母的代数式表示、不必化简)
参考答案: 本题解析:(一)(1)冷凝管,起冷却回流作用;(2)可用MnO2氧化浓盐酸制Cl2;(3)碱石
本题解析:(一)(1)冷凝管,起冷却回流作用;(2)可用MnO2氧化浓盐酸制Cl2;(3)碱石
灰的作用一方面吸收Cl2,防止污染空气,一方面防止空气中的水进入而使PCl3水解;(4)
因PCl3可被氧气氧化,与水反应,所以整个装置要除氧、除水;(二)根据表中的信息,可
通过蒸馏的方法除去PCl3中的杂质;
(三)根据关系式PCl3~H3PO3~I2可求m(PCl3)=137.5x(c1V1-1/2c2V2)x500/25x10-3。
本题难度:一般
2、填空题 (13分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是????????。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:????????????????????????。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO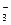 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤(不要求写具体操作过程)
| 预期现象和结论
|
①
②
……
| 若银镜消失,假设2成立。
若银镜不消失,假设2不成立。
?
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO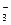 都氧化了Ag。 都氧化了Ag。
你是否同意丙同学的结论,并简述理由:????????????????????????????。
参考答案:(1)ade??
(2)Fe3++Ag= Fe2++A
本题解析:本题第(1)小题是考查学生实验,最后2小题具有较大的开放度。
本题难度:简单
3、实验题 教材必修一课后习题中关于过氧化钠的性质探究实验,某同学在学习后做了如下改进并进行实验:经过改进,用脱脂棉包住约0.2 g 过氧化钠粉末,置于石棉网上,往脱脂棉上滴加几滴水,可观察到脱脂棉剧烈燃烧起来。
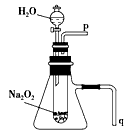
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是: a有氧气生成;b_____________。
(2)某学校研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验操作方法及现象是_____________。
②用以验证结论b的实验操作方法及现象是_____________。
(3)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂:__________________________。现象:__________________________。
参考答案:(1)反应放出热量
(2)①加水后,将带火星的木条置于
本题解析:
本题难度:一般
4、选择题 下列实验操作或事实与预期实验目的或所得结论一致的是(??? )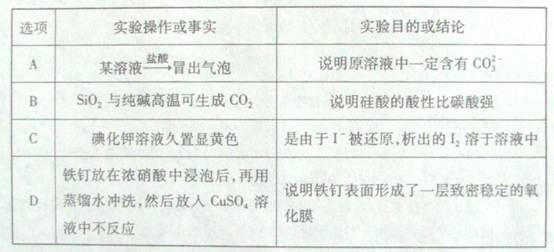
参考答案:D
本题解析:A 错 可能含有碳酸氢根离子,亚硫酸根离子、亚硫酸氢根离子
B 错 硅酸的酸性比碳酸强
C?错KI会被空气中的氧气氧化,生成单质碘,从而显黄色。
D 对常温下,铁在浓硝酸中钝化
本题难度:一般
5、实验题 (15分)氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN—等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
I.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
II.实验验证:破坏性处理CN-的效果。
化学兴趣小组的同学在密闭系统中用图10装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
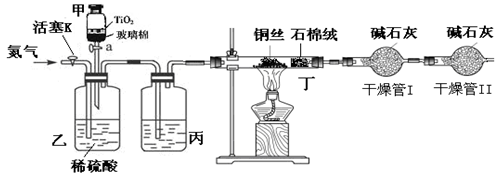
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)倒入甲中,塞上橡皮塞。
步骤3:????????????????????????????????????
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式???????。
(2)完成步骤3?????????????。
(3)丙装置中的试剂是??????????,丁装置的目的是??????????????。
(4)干燥管Ⅱ的作用是????????????????????。
(5)请简要说明实验中通入N2的目的是?????????????。
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为??????。
参考答案:(1)2CNO—+6ClO—+8H+=2CO2↑+N2↑+C
本题解析:(1)次氯酸钠具有强氧化性,能把CNO—氧化生成氮气和CO2,所以反应式为2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O。
(2)由于需要通过加热的铜丝吸收氯气,所以应该先点燃丁处的酒精灯。
(3)因为生成的气体需要干燥,所以丙装置中应该盛放浓硫酸,干燥CO2气体。
(4)干燥管I是吸收CO2的,因此为了防止空气中的水和CO2进入干燥管I中影响对CO2的测量,需要再连接1个干燥管。
(5)由于装置中会残留部分CO2,所以通入氮气的目的是使装置中的CO2全部到干燥管I中被吸收,减少误差。
(6)干燥管Ⅰ中碱石灰增重1.408g,则反应中生成的CO2是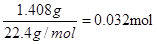 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
本题难度:一般
|