微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 质量为ag的铜丝,在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量仍为ag的是??????????????????????????
A.盐酸
B.2-丙醇
C.一氧化碳
D.硝酸
参考答案:BC
本题解析:
试题分析:铜在空气中加热,生成氧化铜,氧化铜能和酸反应,如果是硝酸,铜也被溶解,所以铜的质量减少。2-丙醇和CO能把氧化铜还原生成铜,因此质量不变,答案选BC。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,难易适中。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练。该题的关键是明确铜参与有关化学反应的原理,然后灵活运用即可。
本题难度:简单
2、填空题 (10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
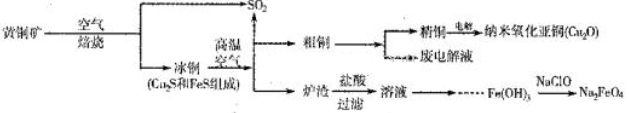
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-)
| 91:9
| 1:1
| 1:91
|
pH(25℃)
| 8.2
| 7.2
| 6.2
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。
参考答案:(1)12.5mol(2分)
(2)2Fe(OH)3+
本题解析:
试题分析:(1)CuFeS2铁元素的化合价为+2,则S元素的化合价为-2价。在反应中铁元素的化合价部分从+2价升高到+3价,失去1个电子。S元素的化合价从-2价升高到+4价,失去6个电子。铜元素的化合价从+2价降低到0价,氧元素的化合价从0价降低到-2价。因此8molCuFeS2处于反应共转移电子的物质的量=8mol×2+21mol×4=100mol,则1molCuFeS2参与反应转移电子的物质的量为 本题难度:困难 本题难度:困难
3、实验题 某校化学 91ExAm.org研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下:
提出猜想
① 在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 常况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO有氧化性,能被H2、CO等还原,也能被氮的气态氢化物还原吗?
实验探究
⑴ 解决问题①需用到的药品有CuSO4溶液、??????????????????????????(填试剂),同时进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取一定量的Cu(OH)2固体,加热至80 ℃~100 ℃时,得到黑色固体粉末,继续加热到1000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜。向氧化亚铜中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。根据以上现象写出氧化亚铜和稀硫酸反应的离子方程式?????????????????????????????。
⑶为解决问题③,设计了如下的实验装置(夹持装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体Y。现有氮的某种气态氢化物X气体0. 0l mol,缓缓通过红热的氧化铜玻璃管完全反应后,测得C装置增重0. 36g并收集到单质气体Y0.28g。
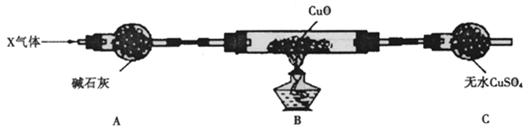
X气体的摩尔质量?????,B中发生反应的化学方程式为????????????????????????。
(4)请猜测用上述装置测量时有可能产生误差的原因??????????????????????????????
.????????????????????????????????????????????????????????????(答1条即可)
实验结论
⑴Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是?????????????????????????
.???????????????????????????????????????????????????????。
⑵ 根据实验方案⑵,得出的+1价Cu和+2价Cu稳定性大小的结论是:???????????????
.?????????????????????????????????????????????????????????????????????????????
⑶ CuO能够被氮的气态氢化物还原。
参考答案:实验探究
⑴ H2SO4(HCl)溶液、浓NaOH溶液
本题解析:略
本题难度:一般
4、实验题 (10分)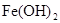 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用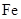 , ,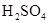 (稀),NaOH溶液可在还原性气氛中制取 (稀),NaOH溶液可在还原性气氛中制取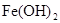 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象. 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.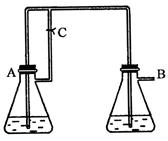
参考答案:铁和稀硫酸 氢氧化钠溶液
①打开弹簧夹C;A中气体由导
本题解析:要产生还原性的气体,应该用铁和稀硝酸反应生成氢气。即A中的试剂是铁和稀硫酸。利用生成的氢气排尽装置中的空气,从而可以防止氢氧化亚铁被氧化。最后利用氢气产生的越强将硫酸亚铁压入氢氧化钠中进行反应,所以B中的试剂是氢氧化钠溶液。具体的操作是①打开弹簧夹C;A中气体由导管进入B,B中有气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛。
②过一段时间,关闭弹簧夹C;A中溶液经导管进入B,B中有白色沉淀生成;因为此时A
中压强增大,使得反应生成的FeSO4溶液进入B,而和NaOH反应,生成Fe(O
本题难度:一般
5、选择题 已知:2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,不可能出现的结果是
A.烧杯中有铜无铁
B.烧杯中有铁无铜
C.烧杯中铁、铜都有
D.烧杯中铁、铜都无
参考答案:B
本题解析:
试题分析:铁粉和铜粉都有欢迎性能。但还原性铁>铜。所以向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,还原性强的铁粉先发生反应产生氯化亚铁,当铁粉反应完全后铜粉再发生反应产生氯化亚铁和氯化铜。故反应结束后烧杯中补可能出现有铁无铜的情况。选项为 :B.
本题难度:一般
|