微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
参考答案:167.94g??? 0.12mol/L
本题解析:本题涉及三个化反应:Ag++Cl-=AgCl↓,2AgCl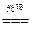 2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
若有①60Ag++60Cl-=60AgCl,则应有②6AgCl 本题难度:一般
本题难度:一般
2、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
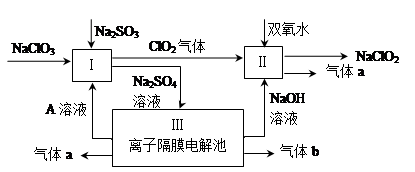
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是?????????、??????????(填化学式)。
(2)Ⅱ中反应的离子方程式是?????????????????????????。
(3)A的化学式是?????????????,装置Ⅲ中A在???????????极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是????????????????。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是??????????????????????????????????????。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是????????????????????。
参考答案:(1)Na2SO3? H2O(2分)
(2)2ClO2
本题解析:
试题分析:(1)Ⅰ中发生的反应是亚硫酸钠被氯酸钠氧化,、Ⅲ中发生的反应是电解水,因此在这两个反应中还原剂分别是:Na2SO3? H2O(2分)
(2)2ClO2 + H2O2 + 2OH- = 2ClO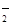 + O2↑+ 2H2O(2分)
+ O2↑+ 2H2O(2分)
(3)Ⅲ装置中左边氢氧根离子放电,剩余的氢离子跟硫酸根离子
本题难度:一般
3、选择题 下列实验现象描述正确的是[???? ]
A.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
参考答案:D
本题解析:
本题难度:一般
4、填空题 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上用电解氯化钠溶液的方式制取氯气,化学反应方程式为
??????????????????????????????????????????????????????????。
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
??????????????????????????????????????????????????????????。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为??????????????????????????????????????。
参考答案:(1)  本题解析:
本题解析:
试题分析:(1)电解氯化钠时,应特别注意阴极产生的是氢气,其化学方程式为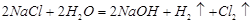 ;
;
(2)注意漂白粉的主要成分是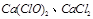 本题难度:一般
本题难度:一般
5、选择题 不能直接使用观察法得出结论是( )
A.氯气是呈黄绿色的气体
B.氯气有强烈的刺激性
C.氯气有毒
D.氯水中含有氯气分子
参考答案:A、氯气是呈黄绿色的气体,能通过观察法确定,故A正确;
本题解析:
本题难度:一般