微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置不能完成的实验是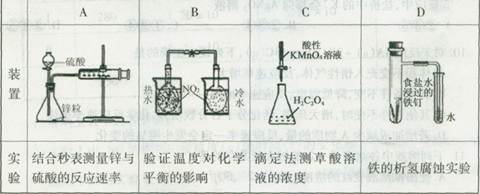
参考答案:D
本题解析:
答案:D
D、铁的析氢腐蚀要在酸性条件下完成。
A、测出单位时间内,气体体积的变化,测出反应速率;B,不同温度时颜色不同;C滴入最后一滴时,紫红色刚好褪去,用KMnO4的浓度,测出H2C2O4的浓度。
本题难度:一般
2、填空题 阅读下列文字,填写文中带圈的数字后面的空白:某同学发现,纯度、质量、表面积都相同的两铝片与
c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:①______________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②______________________。
(2)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积.c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③______________________,实验2中④______________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(3)为了使实验“定量化”。使结果更精确,可以对实验进行如下改进:
1.配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3.质量分数为
20%的硫酸,若要准确量取该硫酸20.00mL,需要用⑤___________________(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为⑥______________________。配制溶液时还需要用到的玻璃仪器有⑦______________、烧杯、胶头滴管和量筒等。
2.比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。⑧______________________。
参考答案:(1)①Cl-对反应没有影响,而SO42-对反应具有阻碍作用
本题解析:
本题难度:困难
3、选择题 已知 3A(g)+2B(g)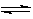 C(s)+4D(g) △H <0。图中a、b表示在一定条件下,A的体积分数随时间t的变化。若使曲线b变为曲线a,可采取的措施是
C(s)+4D(g) △H <0。图中a、b表示在一定条件下,A的体积分数随时间t的变化。若使曲线b变为曲线a,可采取的措施是
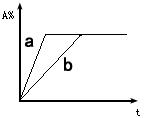 [???? ]
[???? ]
A.增大A的浓度
B.升高温度
C.加催化剂
D.缩小容器体积
参考答案:C
本题解析:
本题难度:一般
4、选择题 把下列不同浓度的X溶液分别加入四个盛有10mL2mol?L-1盐酸的烧杯中,均匀加水稀释到50mL.此时X和盐酸缓缓地进行反应.其中反应速率最大的是( )
A.20mL3mol?L-1的X溶液
B.20mL2mol?L-1的X溶液
C.10mL4mol?L-1的X溶液
D.10mL2mol?L-1的X溶液
参考答案:对比选项中X的物质的量,A中X的物质的量最多,为0.06mo
本题解析:
本题难度:一般
5、选择题 现有下列两个图象:
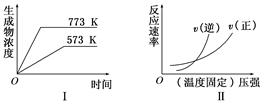
下列反应中符合上述图象的是( ? )
A.N2(g) + 3H2(g) 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.2SO3(g) 2SO2(g) + O2(g) ΔH>0
2SO2(g) + O2(g) ΔH>0
C.4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) ΔH<0
4NO(g) + 6H2O(g) ΔH<0
D.H2(g) + CO2(g)  CO(g) + H2O(g) ΔH>0
CO(g) + H2O(g) ΔH>0
参考答案:B
本题解析:
试题分析:从图Ⅰ可知,升高温度,生成物浓度增大,即平衡向正反应方向移动,说明正反应为吸热反应;从图Ⅱ可知,压强增大,v(逆)>v(正),即平衡向逆反应方向移动,说明逆反应为气体分子数减小的反应,同时满足以上两个条件的只有B选项。
本题难度:简单