微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
求:⑴a的值。
⑵平衡时SO2的转化率。
参考答案:(1)3.65mol????(2)65%
本题解析:
试题分析:(1)???? 2SO2(g)+O2(g)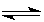 2SO3(g)
2SO3(g)
起始量(mol)??????2.0?????? a???????? 0
变化量(mol)??????1.3????? 0.65?????? 1.3
平衡量(mol)?????0.7?????? 3.0??????? 1.3
则a=3.0mol+0.65mol=3.65mol
(2)平衡时SO3的转化率=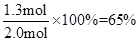
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
2、计算题 将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)  2SO3(g)??测得平衡时混合物总的物质的量为5mol,求:
2SO3(g)??测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
参考答案:(10分)
解:设平衡时SO2转化的物质的量为2a
本题解析:
试题分析:解:设平衡时SO2转化的物质的量为2a
2SO2(g)??+?? O2(g)? ???????2SO3(g)
???????2SO3(g)
起始??? 4 mol???????? 2 mol???????????? 0
转化???? 2a??????????? a?????????????? 2a
平衡??4-2a????????? 2-a???????????? 2a
4-2a+2-a+2a=5
a=1???
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol???? n(O2)="1" mol???? n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L???? c(O2)=0.25mol/L???? c(SO3)="0.5" mol/L??
平衡时SO2的转化率="2" mol /4 mol×100%=50%???
点评:本题考查了三行式的应用;对于化学平衡的计算常用此法,学生要多加练习,此类问题便不难解决。
本题难度:一般
3、填空题 (每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应: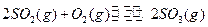
(1)若开始时通入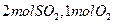 ,达平衡时生成
,达平衡时生成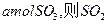 的转化率为????????。
的转化率为????????。
(2)若开始时通入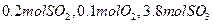 ,达平衡时SO2的物质的量为????mol。
,达平衡时SO2的物质的量为????mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是???????。
参考答案:(1)50 a%?(2)4-2a???(3)![]()
本题解析:略
本题难度:简单
4、选择题 反应N2O4(g)  ?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 (? )
?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 (? )
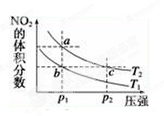
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.b、c两点的平衡常数:b<c
D.a、c两点气体的平均相对分子质量:a>c
参考答案:C
本题解析:
试题分析:反应N2O4(g)  2NO2(g) ΔH=+57 kJ/mol的正反应是气体体积增大的吸热反应。根据平衡移动原理可知:若要使平衡混合物中NO2的体积分数增大,可以采用减小压强或升高温度的方法。A.a、c两点温度相同。而压强c>a.由于增大压强,物质的浓度增大,所以化学反应速率加快,因此a、c的反应速率:c > a.错误。B.由于压强c > a,压强越大,单位体积内的物质越多,浓度越大。因此a、c两点气体的颜色:a浅c深.错误。C.由题图可在:在相同压强下,温度为T2时平衡混合物中NO2的体积分数比T1大。说明温度T2 >T1。即温度c >b。升高温度化学平衡正向移动,所以化学平衡常数增大。因此b、c两点的平衡常数:b<c。正确。D.由于压强c>a。增大压强,化学平衡向气体体积减小的反应,即向逆反应方向移动。气体的物质的量减小,单位物质的量的气体的质量增大。因此a、c两点气体的平均相对分子质量:c > a.错误。
2NO2(g) ΔH=+57 kJ/mol的正反应是气体体积增大的吸热反应。根据平衡移动原理可知:若要使平衡混合物中NO2的体积分数增大,可以采用减小压强或升高温度的方法。A.a、c两点温度相同。而压强c>a.由于增大压强,物质的浓度增大,所以化学反应速率加快,因此a、c的反应速率:c > a.错误。B.由于压强c > a,压强越大,单位体积内的物质越多,浓度越大。因此a、c两点气体的颜色:a浅c深.错误。C.由题图可在:在相同压强下,温度为T2时平衡混合物中NO2的体积分数比T1大。说明温度T2 >T1。即温度c >b。升高温度化学平衡正向移动,所以化学平衡常数增大。因此b、c两点的平衡常数:b<c。正确。D.由于压强c>a。增大压强,化学平衡向气体体积减小的反应,即向逆反应方向移动。气体的物质的量减小,单位物质的量的气体的质量增大。因此a、c两点气体的平均相对分子质量:c > a.错误。
本题难度:简单
5、选择题 在反应:Fe2(SO4)3+6KSCN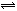 2Fe(SCN)3+3K2SO4达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是:
2Fe(SCN)3+3K2SO4达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是:
A.KSCN
B.K2SO4
C.NaOH
D.FeCl3。
参考答案:B
本题解析:【分析预测及备考建议】化学平衡在高考中主要从两方面进行考查,一方面是定性考查平衡的移动,即在改变条件时,定性解析平衡移动的原理,另一方面是定量的计算,如反应方程式系数的确定、反应进行的程度等。
【答题技巧】写出该反应的离子方程式:Fe3++3SCN-=Fe(SCN)3可知, K+、SO42-实际与反应无关,而加入KSCN时可增大KSCN 、FeCl3的浓度,平衡正向移动;加入NaOH时可与Fe3+反应生成Fe(OH)3沉淀,使Fe3+减少,平衡逆移。
本题难度:一般