微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.降低温度
B.增大压强
C.使用催化剂
D.增大反应物浓度
2、计算题 把0.2molX气体和0.5molY气体混合于1L密闭容器中,使它们发生如下反应:2X(g)+3Y(g)=nZ(g)+4W(g)。2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L?min),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
3、选择题 下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小
C.SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢
D.对于CaCO3+2HCl===CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示
4、选择题 可逆反应:A+3B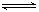 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是
A.u(D)=0.4 mol / (L·s)????????????? B.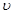 (C)=0.8mol / (L·s)
(C)=0.8mol / (L·s)
C.u(B)=0.6 mol / (L·s)??????????? D.u(A)=0.5 mol / (L·s)
5、填空题 (16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g)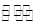 2NH3(g)?
2NH3(g)?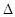 H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为???????????。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为???????????。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
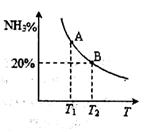
①温度T1、T2时的平衡常数分别为K1、K2,则K1?????K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡?????移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)=?????????。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡?????移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)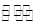 H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
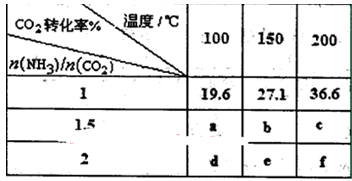
①则该反应△H???0,表中数据a???d,b???f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理????????????。