微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是
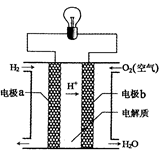
A.该电池的总反应:2H2+O2=2H2O
B.该电池中电极b是负极
C.外电路中电子由电极b通过导线流向电极a
D.该电池工作时电能转化为化学能
参考答案:A
本题解析:试题分析:根据原电池的工作原理可知,负极电极反应式2H2-4 e-=4H+,正极电极反应式为O2+4H++4e-=2H2O,正负极电极反应式相加得电池反应式2H2+O2=2H2O,故A正确;氢氧燃料电池中,通入氢气的一极为电源的负极,所以电极a是负极,故B错误;氢氧燃料电池中,通入氧气的一极为电源的正极,发生还原反应,外电路中电子由电极a通过导线流向电极b,故C错误;氢氧燃料电池中是把化学能转化为电能,故D错误,答案选A。
考点:考查氢氧燃料电池的有关判断
点评:该题以氢氧燃料电池为载体,重点考查学生对原电池原理的熟悉了解程度,实验中等难度的试题。注意电极方程式的书写,电极反应式与电解质溶液的酸碱性有关,电极反应式相加时,得失电子数必须相等等。
本题难度:简单
2、填空题 (11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为:
(2)①pH=1的溶液呈酸性,各离子互不反应,可以大量共存;②酸性溶液中,NO3?、H+与Fe2+发生氧化还原反应,不能大量共存;③各离子互不反应,可以大量共存;④HCO3?与H+反应,不能大量共存。
(3)A、2F2+2H2O=4HF+O2, 依据化合价变化,水中O元素化合价升高,水做还原剂;B、2Na2O2+2H2O=4NaOH+O2↑,据化合价变化,此反应是过氧化钠的自身氧化还原反应,水既不是氧化剂也不是还原剂;C、CaH2+2H2O=Ca(OH)2+2H2↑,依据化合价变化,水中的氢元素化合价降低,水做氧化剂;D、3Fe+4H2O(g) Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
(4)负极上H2失去电子,电极方程式为:H2+2OH?—2e?=2H2O;H2O的密度约为100g/L,所以1.8 L H2O的物质的量为:1800g÷18g/mol=100mol,根据电池总反应2H2+O2=2H2O可得对应关系:H2O ~ 2e?,所以电子转移为200mol,数目为200NA。
考点:本题考查电子式、离子共存、氧化还原反应原理、原电池原理。
本题难度:一般
3、选择题 把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由到小为
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:B
本题解析:
试题分析:要判断金属的活动性,可以采用原电池的方法,当两种活泼金属分别作为电池的正负极,做负极的说明活动性强,所以a、b相连时,a为负极,说明a>b,c、d相连时,c为负极,说明c>d ,a、c相连时,c为正极,说明a>c,b、d相连时,b为正极,说明d>b,所以这四种金属活动性顺序由到小为a>c>d>b,故本题的答案为B。
点评:本题通过利用原电池来判断金属的活动性,有一定的综合性,该考点是高考考查的热点,本题只要掌握相关的知识即可很快地选择出正确的答案。
本题难度:一般
4、选择题 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.放电时正极反应为Mo3S4+2xe-=Mo3S42x-
C.充电时Mo3S4发生氧化反应
D.充电时阴极反应为Mg2++2e-=Mg
参考答案:C
本题解析:利用原电池工作原理可知,原电池工作时电解质溶液中阳离子移向正极,A正确;由Mg升高至+2价,结合总反应式可知共转移2x mol电子,正极得电子发生还原反应,故可知B项正确;充电时,发生氧化反应与还原反应的均为MgxMo3S4,C项错误;充电时阴极发生还原反应得到金属镁,D项正确。
点拨:本题考查原电池,考查考生的理解能力。难度中等。
本题难度:一般
5、选择题 用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是(??)
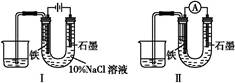
A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多
B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2↓
C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑
D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低
参考答案:B
本题解析:图Ⅰ中,铁作阴极,在铁电极上析出H2,在石墨电极上析出Cl2,根据电子守恒,得到的气体一样多,故A错误;由题中现象信息知图Ⅱ装置发生类似铁吸氧腐蚀的反应,石墨极上氯气得电子生成Cl-,故C错误;图Ⅰ中铁电极上氢离子得电子生成氢气,导致铁电极附近氢氧根离子浓度增大,pH升高,故D错误。
本题难度:一般