微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列给定条件的溶液中,一定能大量共存的粒子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.常温下, =0.001 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
=0.001 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
C.常温下由水电离出来的c(H+)=1.0×10 -13mol·L-1溶液中:AlO2-、K+、SO42-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3-
参考答案:B
本题解析:
试题分析:A.能使pH试纸呈红色的溶液是酸性溶液,I-、NO3-在酸性溶液中反应,不能大量共存,A项错误;B.常温下, =0.001 mol·L-1的溶液是碱性溶液,Na+、K+、SiO32-、NO3-各离子能大量共存,B项正确;C.常温下由水电离出来的c(H+)=1.0×10 -13mol·L-1<10-7mol/L,是酸或碱溶液,在酸溶液中,AlO2-与H+反应生成Al(OH)3沉淀,C项错误;D.与铝反应产生大量氢气的溶液是酸性或碱性溶液,在碱性溶液中,NH4+与OH-反应不能大量共存,在酸性溶液中,NO3-不存在,D项错误;选B。
=0.001 mol·L-1的溶液是碱性溶液,Na+、K+、SiO32-、NO3-各离子能大量共存,B项正确;C.常温下由水电离出来的c(H+)=1.0×10 -13mol·L-1<10-7mol/L,是酸或碱溶液,在酸溶液中,AlO2-与H+反应生成Al(OH)3沉淀,C项错误;D.与铝反应产生大量氢气的溶液是酸性或碱性溶液,在碱性溶液中,NH4+与OH-反应不能大量共存,在酸性溶液中,NO3-不存在,D项错误;选B。
考点:考查离子共存。
本题难度:困难
2、选择题 室温下,下列叙述正确的是(溶液体积变化忽略不计)?
?
| ①
| ②
| ③
| ④
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸
| 盐酸
|
pH
| 11
| 11
| 3
| 3
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
D.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
参考答案:D
本题解析:
试题分析:氯化铵能抑制氨水的电离,另外氯化铵还能和氢氧化钠反应生成氨水,所以溶液的pH均是降低的,A不正确;B不正确,不符合电荷守恒c(C1-)+c(OH-)=c(NH4+)+c(H+);C不正确,也是不符合电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),即若所得溶液的pH=7,则c(CH3COO-)=c(Na+);醋酸在稀释过程中,会
本题难度:一般
3、填空题 (10分)某同学设计如下实验方案,分离KCl和BaCl2两种固体混合物。
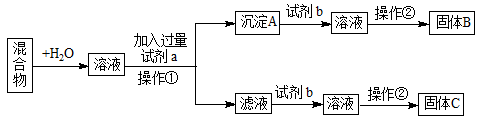
试回答下列问题:
(1)试剂a是 ;试剂b是 ;固体B是 。(填化学式)
(2)操作②的名称是: 、 、干燥。
(3)加入试剂a所发生的离子方程式为: 。
沉淀A与试剂b所发生的离子方程式为: 。
参考答案:(1)K2CO3(2分);HCl(1分);BaCl2(1分)
本题解析:
试题分析:分离KCl和BaCl2两种固体混合物所以最后的到的固体B、C是KCl和BaCl2,在加入试剂A时沉淀的离子是Ba2+,因为K+不能生成沉淀,Cl-沉淀的话只有生成Ag Cl,,不能再溶解生成KCl,所以就沉淀Ba2+,沉淀还要可以转化成BaCl2,所以沉淀A应该是BaCO3,可以与盐酸反应得到BaCl2,为了不引入新的杂质离子,试剂b是盐酸,a试剂是K2CO3,滤液就是K2CO3和KCl的混合物,加入盐酸可以将K2CO3转化为KCl。根据上述分析:(1)试剂a是K2CO3;试剂b是HCl;固体B是BaCl2(2)操作②是获得溶液中的溶剂,所以操作是蒸发、结晶。(3)加入K2CO3与BaCl2反应的离子方程式为:CO +Ba2+ +Ba2+ BaCO3↓,沉淀A与试剂b就是BaCO3 和盐酸,它们反应的离子方程式为:BaCO3 +2H+ BaCO3↓,沉淀A与试剂b就是BaCO3 和盐酸,它们反应的离子方程式为:BaCO3 +2H+ Ba2+ + CO2↑+H2O Ba2+ + CO2↑+H2O
考点:根据流出推出物质的名称、离子方程式的书写、物质的分离方法。
本题难度:一般
4、选择题 某无色溶液中加入氢氧化铝,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是
A.K+、Ba2+、NO3-、Cl-
B.Na+、K+、CO32—、SO42-
C.Na+、K+、Fe2+、NO3-
D.Na+、Fe3+、Cl—、SCN—
参考答案:A
本题解析:略
本题难度:简单
5、选择题 在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是(?)
A.Na+、Cu2+、CO32-、Cl-
B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+
D.NH4+、 K+、 H+、 SO42-
参考答案:B
本题解析:略
本题难度:一般
|