微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核电荷总数为42,B、C同周期,A、D同主族.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是______,C元素在周期表中的位置是______.
(2)C和D的离子中,半径较小的是______(填离子符号).
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______.
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是______.

参考答案:A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1
本题解析:
本题难度:一般
2、选择题 只含非金属元素的晶体描述正确的是
A.有可能是金属晶体
B.有可能是离子晶体
C.一定是分子晶体
D.一定不是原子晶体
参考答案:B
本题解析:
试题分析:非金属元素的晶体有可能是离子晶体,如铵盐;有可能形成原子晶体,如晶体硅;也有可能为分子晶体,如二氧化碳分子晶体;但绝对不会形成金属晶体。
本题难度:一般
3、填空题 图(1)是NaCl的晶体结构。在NaCl的晶体结构中,钠离子和氯离子可以被看成是不等径的刚性网球,并彼此相切如图(2)。离子键的键长是相邻阴、阳离子的半径之和如图(3),已知a为常数。
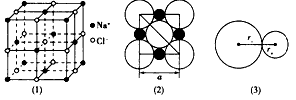
试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引_______个Cl-,Na+数目与C1-数目之比为_____。
(2)Na+半径与Cl-半径之比为r+:r-=_______(已知 = 1.414,=1.732,=2.236)。
(3)NaCI晶体不存在分子,但在温度达到l 413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6 L (已折算为标准状况),则此时氯化钠气体的分子式为________。
参考答案:(1)6;1:1
(2)0.414:1
(3
本题解析:
本题难度:一般
4、填空题 (三选一)【选修3:物质结构与性质】
硅与金刚砂(SiC)是两种重要的工业产品,它们都可由二氧化硅与碳反应制得。
(1)由SiO2生成SiC的化学方程式是_________________。?氮化硅(Si3N4)也是一种高硬度高沸点的物质,其制备方法是在H2的保护下,使SiCl4与N2反应沉积在石墨表面,形成一层致密的氮化硅层,写出该反应的化学方程式_______________________。
(2)基态Si原子的价电子排布式为________;Si与C相比,电负性较大的是_________(填元素符号)。???
(3)从原子轨道重叠的角度,X分子中含有的化学键是____________,X可与氧气反应生成Y,Y分子的中心原子杂化轨道类型是__________,键角是_____________。SiO2与HF溶液反应可以生成一种气态物质,该物质的立体构型为__________________。
(4)SiC的一种晶体与晶体硅的结构相似,其中C原子和Si原子的位置是交替的,在SiC中最小的环上有________个原子,SiC与晶体硅相比,_________熔点较高,原因是______________________________?。
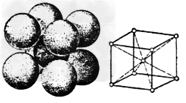
(5)生铁中存在着碳铁化合物。若铁晶体的晶胞结构如图,铁的密度是dg/cm3,则铁原子的半径是_________cm。(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
参考答案:(1)SiO2+?2C==SiC+?2CO;3SiCl4+2
本题解析:
本题难度:一般
5、选择题 下列物质属于分子晶体的是(???)???????????????????????????
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.能溶于水,熔点812.8℃,沸点是1446℃
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
参考答案:B
本题解析:
试题分析:分子晶体的熔沸点比较低,有些能够在水中溶解,有些不能在水中溶解。固体或液态时本身不能导电,水溶液有的导电,有的不导电。综上所述,正确的选项为B。
本题难度:一般