微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
参考答案:(1)④②③①;(2)⑥⑦④⑤⑧;(3)c(Na+)=c(C
本题解析:
试题分析:(1)根据水的离子积以及水电离出c(H+)=c(OH-),假设温度是常温下,①0.1mol·L-1H2SO4溶液中的OH-来自水,c(OH-)=  =5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)=
=5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)= 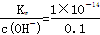 =1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O
=1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O
NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即:
CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即: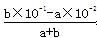 =10-2,解得:a:b=9:2。
=10-2,解得:a:b=9:2。
考点:考查水的离子积的计算、弱电解质的电离、影响盐类水解的因素、pH的计算等相关知识。
本题难度:困难
2、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
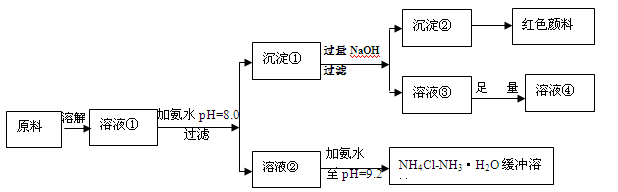
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
参考答案:(1)大 &#
本题解析:
试题分析:(1)pH相同的氨水和烧碱,氨水的物质的量浓度大,所以需要的酸的体积大。(2) 溶液的pH=8,氢离子浓度=10-8mol/L,氢氧根离子浓度=10-6mol/L,根据Ksp[Fe(OH)3]=4.0×10-38计算铁离子浓度=4.0×10-20。
(3)缓冲溶液中有铵根离子,所以存在铵根离子的水解平衡,NH4++H2O NH3·H2O+H+,溶液中有一水合氨,NH3·H2O
NH3·H2O+H+,溶液中有一水合氨,NH3·H2O NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O
NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s)
H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
考点:盐类的水解。
本题难度:困难
3、选择题 将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是:
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
参考答案:C
本题解析:
试题分析:A、D两项都是易溶于水的盐,阴离子数均为0.1mol,B项在水中为难溶盐,故阴离子浓度小于0.1mol,故选择C项。
考点:盐类的水解。
点评:题目中给都是0.1mol的物质的量的物质,所以选项中可能出现盐类水解,沉淀,弱电解质等会影响离子电离的因素。
本题难度:一般
4、选择题 下列溶液中有关物质的量浓度关系不正确的是
A.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(H+)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中: c(Na+)=c(NH4+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+ c(NH3·H2O) + c(Fe2+)="0.3" mol·L-1
参考答案:D
本题解析:A.由pH=—lgc(H+)可知,pH相等,则c(H+)相等,正确
B.两溶液中分别存在电荷守恒:c(H+)+ c(Na+)=c(OH-)、c(H+)+ c(NH4+)=c(OH-),由于pH相同,则两溶液中的c(H+)、c(OH-)均对应相等,则必定 c(Na+)=c(NH4+),正确
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
其中电荷守恒为: c(CH3COO-)+c(OH-)=c(H+)+c(Na+)
物料守恒为: c(CH3COO-)+c(CH3COOH)=2c(Na+)
合并两式可得: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),正确
D.由物料守恒可知c(NH4+)+ c(NH3·H2O) ="0.2" mol·L-1,而由于Fe2+部分水解,其浓度必定小于0.1 mol·L-1,故不正确
答案为D
本题难度:一般
5、选择题 下列各选项所描述的两个量中,前者一定大于后者的是
A.NH4NO3溶液中NH4+和NO3-的数目
B.纯水在80℃和25℃时的pH
C.pH与体积都相同的氨水和NaOH溶液分别用0.1 mol·L-1盐酸恰好中和,所需的盐酸体积
D.相同温度下,pH =12的NaOH溶液和Na2CO3溶液中由水电离出的c (OH-)
参考答案:C
本题解析:
试题分析:A、NH4+发生水解反应,所以NH4NO3溶液中NH4+的数目小于NO3-的数目,故A错误;B、温度升高,水的电离程度增大,H+浓度增大,则纯水在80℃时的pH小于25℃时的pH,故B错误;C、因为氨水是弱碱,NaOH是强碱,所以pH与体积都相同的氨水和NaOH溶液,氨水中溶质物质的量大,则分别用0.1 mol·L-1盐酸恰好中和,所需的盐酸体积氨水大,故C正确;D、Na2CO3为强碱弱酸盐,CO32?发生水解反应,H2O的电离程度增大,所以相同温度下,pH =12的NaOH溶液中由水电离出的c (OH-)小于 Na2CO3溶液中由水电离出的c (OH-),故D错误。
考点:本题考查弱电解质的电离、盐类的水解。
本题难度:一般