2.50
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
参考答案:C
本题解析:
A、500 s内N2O5分解速率=(5.00-3.52)mol·L-1/500 s=2.96×10-3 mol·(L·s)-1,故正确;
B、分析表中数据,得:1000 s时达平衡;?? 2N2O5(g)  4NO2(g)+O2(g) 4NO2(g)+O2(g)
C(初始)???? 5.00????????? 0?????? 0
△C??????? 2.50???????? 5.00????? 1.25
C(平衡)2.50???????? 5.00?????? 1.25
K1=([NO2]4[O2])/[ N2O5]2 ,代入数据,得:K1=125
1000 s时转化率="2.50/5.00=50%" ,故正确;
C、T1温度下反应到1000 s时测得N2O5(g)浓度为2.50 mol·L-1,
T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,
即:T1到T2,N2O5(g)浓度的增大,平衡逆向移动,逆向为放热的,则T1>T2,故错误;
D、K1>K3,说明(T1到T3)K值减小,平衡逆向移动,逆向为放热的,则T1>T3,故正确
本题难度:一般
2、选择题 在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均相对分子质量减小的是
A.H2(g)+Br2(g) 2HBr(g)ΔH<0 2HBr(g)ΔH<0
B.N2(g)+3H2(g) 2NH3(g)ΔH<0 2NH3(g)ΔH<0
C.A(s) B(s)+ C(g)ΔH>0 B(s)+ C(g)ΔH>0
D.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0
参考答案:B
本题解析: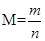 ;升高温度,ABD逆向移动,但只有B的体积增大,即质量不变条件下,物质的量增大,M减小。故B正确。 ;升高温度,ABD逆向移动,但只有B的体积增大,即质量不变条件下,物质的量增大,M减小。故B正确。
本题难度:一般
3、选择题 将4mol A和2mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g) ΔH<0。 2C(g) ΔH<0。
4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率增大,平衡常数增大
B.当c(A)︰c(B)︰c(C)=2︰1︰2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.4 s内,υ(B)=0.075 mol/(L ·s)
参考答案:D
本题解析:平衡常数只与温度有关系,选项A不正确;在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,选项B不正确;升高温度平衡向逆反应方向进行,C的浓度减小;C的浓度为0.6 mol/L,则消耗B是0.3mol/L,所以B物质的反应速率是0.3mol/L÷4s=0.075 mol/(L ·s),答案选D。
本题难度:一般
4、简答题 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g)?3C(g),已知加入1mol A和3mol B且达平衡后生成a?mol C,
回答下列问题:
(1)平衡时C在反应混合气体中的体积分数是?(用字母a表示).
(2)在相同实验条件下,若在同一容器中改为加入2mol A和6mol B,达平衡后,C的物质的量为?mol(用字母a表示).此时C在反应混合气中的体积分数?(填增大、减少或不变).
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中的体积分数不变,则还应加入C?mol.
(4)在同一容器中加入n?molA和3n?molB,在平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m之间变化,那么n与m的关系应是?(用字母m、n表示).
参考答案:
本题解析:
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是(??? )
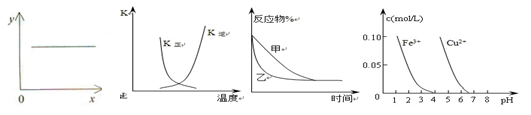
图1?????????????图2???????????图3???????????????图4
A.图1表示反应2NO(g)+2CO(g)  N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化 N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化
B.图2中表示反应2A(g) + B(g) 2C(g) ΔH > 0的平衡常数K随温度的变化 2C(g) ΔH > 0的平衡常数K随温度的变化
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大 3C(g)+D(s)的影响,乙的压强比甲的大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5左右
参考答案:A
本题解析:
试题分析:化学平衡常数只与温度有关系,A不正确;B中反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数是增大的,B不正确;C中反应是体积减小的可逆反应,增大压强平衡向正反应方向移动,反应物的含量降低,C不正确;D不正确,因为pH=5时,溶液中会析出氢氧化铜沉淀,应该是至4左右,答案选A。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
|