微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列条件下,两瓶气体所含分子数一定相等的是
A.同体积、同密度的O3和O2
B.同温度、同体积的H2和N2
C.同体积、同密度的N2和CO
D.同压强、同体积的N2O和CO2
参考答案:C
本题解析:
试题分析:A.同体积同密度的氧气和臭氧质量相等,但是由于摩尔质量不同,故分子数不相等,故A不选;B.同温度同体积的两种气体,没有说明压强,气体的物质的量不能确定,故B不选;C.同体积同密度的氮气和一氧化碳质量相等,由于摩尔质量相同,故物质的量相等,分子数相等,所以C选;D.同压强同体积,未说明温度,不能确定物质的量的关系,故D不选。
考点:阿伏伽德罗定律的应用。
本题难度:一般
2、选择题 设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1 mol [Cu(NH3)4]2+中含有σ键的数目为12NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
参考答案:C
本题解析:
试题分析:A.单键都是σ键构成的,1 mol [Cu(NH3)4]2+中含有4mol氨气,另外氮原子与铜离子之间还有配位健,因此σ键的数目为16NA,A错误;B.根据方程式3Fe+4H2O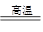 Fe3O4+4H2↑可知0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.133NA,B错误;C.氮气和氨气分子中均含有3对电子对,则分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA,C正确;D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,这说明反应中阴极产生了0.1mol铜和0.05mol氢气,则该电解过程中转移电子的数目为0.3NA,D错误,答案选C。
Fe3O4+4H2↑可知0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.133NA,B错误;C.氮气和氨气分子中均含有3对电子对,则分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA,C正确;D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,这说明反应中阴极产生了0.1mol铜和0.05mol氢气,则该电解过程中转移电子的数目为0.3NA,D错误,答案选C。
考点:考查阿伏加德罗常数的计算
本题难度:一般
3、选择题 设NA为阿伏加德罗常数,下列说法正确的是( ? )
A.将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶体粒子。
B.相同物质的量浓度的氨水和盐酸相比,氨水的导电能力强
C.154g CCl4在标准状况下的体积是22.4L
D.H2SO4是电解质,但是H2SO4不能导电。
参考答案:D
本题解析:
试题分析:胶体粒子不是单个小分子而是分子簇,所以1mol FeCl3饱和溶液不能得到1molFe(OH)3胶体粒子,A错误;氨水弱电解质,盐酸强电解质,相同浓度时,强电解质到点能力强,B错误;CCl4是液体,不能用22.4L表示体积,C错误。答案选D。
点评:本题综合性强,但是非常基础简单。
本题难度:一般
4、选择题 25℃时,在等体积的① pH=0的H2SO4溶液??②0.05mol/L的Ba(OH)2溶液?③pH=10的Na2S溶液?④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1:10:10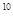 :10
:10
B.1:5:5×10 :5×10
:5×10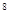
C.1:20:10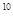 :10
:10
D.1:10:10 :10
:10
参考答案:A
本题解析:在强酸、强碱溶液中,水的电离受抑止;在能水解的盐溶液中,水的电离促进
A:pH=0的H2SO4溶液,其中的OH—全部由水的电离来提供,其值为:10—14mol/L
B: 0.05mol/L的Ba(OH)2溶液,c(OH—)=10—1mol/L,其中的H+全部由水的电离来提供,其值为:10—13mol/L
C:pH=10的Na2S溶液中,c(OH—)=10—4mol/L,全部由水的电离提供
D:pH=5的NH4NO3溶液中,c(H+)=10—5mol/L,全部由水的电离提供
则
本题难度:简单
5、选择题 下列叙述正确的是( )
A.标准状况下的气体摩尔体积约为22.4L
B.H2的摩尔质量为2g/mol
C.摩尔是用来衡量微观粒子多少的一种物理量
D.0.1molH2SO4含有氢原子数的准确值为1.204×1023
参考答案:B
本题解析:
本题难度:简单