微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2(强碱)溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤.往得到的沉淀中加入过量的NaOH溶液,沉淀减少.
根据上述实验,这包粉末中一定不含有的离子是______,肯定含有的离子是______,不能确定是否含有的离子是______,可通过______来进一步确定该离子.
参考答案:(1)加入稀硝酸无气体放出,说明原溶液中无CO32-;
本题解析:
本题难度:一般
2、选择题 常温下,下列各组离子在指定溶液中可能大量共存的是
A.FeCl3溶液中:Al3+、K+、MnO4-、SO42-
B.甲基橙呈黄色的溶液中:K+、Br-、S2-、ClO-
C.加入铝粉产生氢气的溶液中:Na+、NH4+、NO3-、Cl-
D.Kw/c(OH-)=0.1mol/L的溶液中:Na+、K+、AlO2-、CO32-
参考答案:A
本题解析:
分析:A.该组离子之间不反应;
B.甲基橙呈黄色的溶液中显酸性;
C.加入铝粉产生氢气的溶液,为酸或强碱溶液;
D.Kw/c(OH-)=0.1mol/L的溶液中,c(H+)=0.1mol/L,溶液显酸性.
解:A.该组离子之间不反应,则能大量共存,故A正确;
B.甲基橙呈黄色的溶液中显酸性,S2-、ClO-发生氧化还原反应,则不能共存,故B错误;
C.加入铝粉产生氢气的溶液,为酸或强碱溶液,酸性溶液中Al与NO3-反应不生成氢气,碱溶液中NH4+、OH-反应,则
本题难度:一般
3、选择题 现有室温下的四种溶液,有关叙述不正确的是
编号
| ①
| ②
| ③
| ④
|
pH
| 11
| 11
| 3
| 3
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸溶液
| 盐酸
?
A.相同体积的③、④溶液分别与NaOH完全反应,消耗NaOH的物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中:c(Cl-)>c(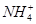 )>c(OH-)>c(H+) )>c(OH-)>c(H+)
D.Va L④溶液与Vb L②溶液混合[近似认为混合溶液体积=(Va+Vb)L],若混合后溶液的pH=4,则Va∶Vb=11∶9
参考答案:C
本题解析:C项不符合电荷守恒,①、④两溶液等体积混合,所得溶液为NH4Cl和氨水的混合溶液,一水合氨的电离程度大于NH4Cl的水解程度,正确的顺序是:c(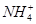 )>c(Cl-)>c(OH-)>c(H+)。 )>c(Cl-)>c(OH-)>c(H+)。
本题难度:一般
4、选择题 在加入铝粉能放出H2的溶液中,一定能大量共存的离子组是( )
A.K+、Na+、CO32-、SO42-
B.NH4+、Na+、Cl-、HCO3-
C.K+、Na+、Cl-、SO42-
D.K+、Na+、OH-、SO42-
参考答案:A.如溶液呈酸性,则CO32-不能大量存在,故A错误;
本题解析:
本题难度:一般
5、选择题 下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是
A.该溶液中,Na+、H+、Cl-、NO3-可以大量共存
B.和新制氯水反应的离子方程式:Fe2++Cl2=Fe3++2Cl-
C.加入NaOH溶液至Fe2+刚好沉淀完全的离子方程式: Fe2++2OH-=Fe(OH)2↓
D.离子浓度关系:c(SO42-) = c(NH4+ )>c(Fe2+ )>c(H+ )>c(OH-)
参考答案:C
本题解析:
试题分析:A、亚铁离子在氢离子存在下,被硝酸根离子氧化成铁离子,所以不能大量存在,不选A;B离子方程式不遵循电荷守恒,不选B;C、溶液中亚铁离子先和氢氧化钠反应生成氢氧化亚铁沉淀,正确,选C;D、由于铵根离子水解,所以硫酸根离子浓度大于铵根离子浓度,亚铁离子也水解,使溶液显酸性,所以错误,不选D。
考点:离子共存,离子反应
本题难度:困难
|