微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实能说明NH3?H2O一定是弱电解质的是( )
①常温下,NH3?H2O溶液能使酚酞变红;????
②用NH3?H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol/L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3?H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者.
A.①②③④
B.②③④
C.③④
D.②④
2、选择题 已知氨水中存在电离平衡NH3·H2O 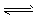 NH4++OH-,下列有关说法正确的是
NH4++OH-,下列有关说法正确的是
[???? ]
A.若向氨水中加入氯化铵晶体,则溶液中的c(NH4+)减小
B.氨水中存在c(NH4+)+c(H+)=c(OH-)
C.若加热,则溶液中的c(NH4+)浓度肯定增大
D.若向氨水中加入醋酸钠,则一定有c(NH4+)= c(CH3COO-)
3、选择题 HClO是比H2CO3更弱的酸,反应Cl2+H2O HCl+HClO达到平衡后,要使HClO浓度增大可加入(???)
HCl+HClO达到平衡后,要使HClO浓度增大可加入(???)
A.NaOH
B.HCl
C.CaCO3
D.H2O
4、选择题 在25?℃时,用蒸馏水稀释1?mol·L-1氨水至0.01?mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是(??)
A.c(NH4+)/c(OH-)
B.c(OH-)/c(NH3·H2O)
C.c(NH3·H2O)/c(NH4+)
D.OH-物质的量
5、填空题 25℃时,0.1mol·L-1 HA溶液pH=2,0.1mol·L-1 HB溶液pH=3。
(1)前 者大于后者的是 (多选、错选均不给分,下同);
者大于后者的是 (多选、错选均不给分,下同);
①HA、HB的电离平衡常数 ②HA、HB的电离度 ③溶液中的c(OH-)
④溶液的导电性 ⑤溶液中由水电离出的c(H+)
(2)若HA、HB溶液的pH相同、体积相等,前者小于后者的是 ;
①HA、HB物质的量浓度 ②同时加入足量的锌,开始反应时速率
③同时加入足量的锌,反应完全后生成H2的质量 ④二种酸溶液的导电能力
⑤用1mol/LNaOH溶液分别中和二种酸,消耗NaOH溶液体积
⑥将这两种溶液分别稀释10倍后溶液的pH。 (3)若中和体积为Va浓度为0.1mol·L-1 HA溶液,消耗0.1mol·L-1 NaOH溶液的体积为Vb,且Va>Vb,下列说法一定正确的是 。(提示:CH3COONa溶液呈碱性)
①混合后溶液呈中性 ②混合后溶液呈酸性  ③混合后溶液呈碱性
③混合后溶液呈碱性
④混合后溶液中的溶质为NaA ⑤混合后溶液中的溶质为NaA和HA
⑥混合后溶液中的溶质为NaA和NaOH