微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 恒温下,将3 mol N2与6 mol H2的混合气体通入一个体积为2L的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)  2NH3(g),5min后达到平衡,平衡时生成NH3的物质的量为2.4mol???????????????????????????????????
2NH3(g),5min后达到平衡,平衡时生成NH3的物质的量为2.4mol???????????????????????????????????
(1)以NH3的浓度变化来表示的化学反应速率为_______
(2)N2的转化率为_______
(3)平衡混合气体中NH3的体积分数为_______
(4)反应前后容器内气体压强之比为 ________
参考答案:(1)????0.24 mol /L?? ??????
本题解析:
本题难度:一般
2、选择题 在一定温度下,反应H2(g)+X2(g) 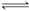 HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5%
B.17%
C.25%
D.33%
参考答案:B
本题解析:反应H2(g)+X2(g) 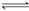 HX(g)中,HX(g)的最大分解率即达到平衡状态;
HX(g)中,HX(g)的最大分解率即达到平衡状态;
根据反应:HX(g) 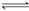 H2(g)+X2(g)
H2(g)+X2(g)
起始浓度?? 1???????? 0?????? 0
变化浓度?? 2x??????? x?????? x
平衡浓度 1-2x??????? x?????? x
由于反应H2(g)+X2(g)  HX(g)的平衡常数为10,则HX(g)
HX(g)的平衡常数为10,则HX(g)  H2(g)+X2(g)的平衡常数为
H2(g)+X2(g)的平衡常数为 ;所以
;所以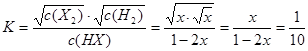 ;解得
;解得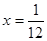 ;在该温度时HX(g)的最大分解率=
;在该温度时HX(g)的最大分解率=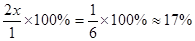
本题难度:一般
3、填空题 1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应并达平衡:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入Na2SO4_________________。②加入焦炭________________。
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,Na2SO4的转化率是_______________。
(3)若将容器温度升高20℃,H2在混合气体中含量变化用下图中_____?????图表示最合适。
参考答案:(1)①无②正向移动????(2)50%????(3) A
本题解析:(1)考查外界条件对平衡的影响。
①硫酸钠是固体,改变固体的质量,平衡不移动。
②高温下,焦炭和水蒸气反应生成氢气和CO,相当于是降低生成物浓度,增加反应物浓度,所以平衡向正反应方向移动。
(2)设硫酸钠的转化率是x。硫酸钠是0.01mol,则生成硫化钠是0.01x,所以142×(0.01-0.01x)+0.01x×78=1.10,解得x=50%。
(3)由于正反应是放热反应,所以升高温度,平衡向逆反应方向进行,氢气的含量增加,所以答案选A。
本题难度:一般
4、选择题 对于平衡体系:mA(气)+nB(气) ≒pC(气)+qD(气) △H <0,下列判断正确的是
A. 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C. 若平衡体系共有气体a mol,再向其中加入b molB物质,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n =q+p
D. 温度不变时,若压强增大为原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
参考答案:BC
本题解析:A、将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2.1倍,说明平衡向着生成A的方向移动了,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n<p+q,故A错;B、反应开始时,A、B的物质的量之比为m:n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,故B正确;C、若m+n=p+q,则往含有amol气体时建立的平衡和向平衡体系中加入amol的B时建立的平衡等同,所以往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,C正确;D、若该反应中,m+n=p+q,温度不变时,压强增大到原来的2倍,达到新平衡时,总体积变为原来的1/2,故D错.故本题选BC.
本题难度:一般
5、选择题 可以说明反应2HI(g) H?2(g)+I2(g)已达到平衡的是(???? )
H?2(g)+I2(g)已达到平衡的是(???? )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③百分组成ω(HI)=ω(I2)
④反应速率υ(H2)=υ(I2)=1/2υ(HI)时
⑤ c(HI):c(H2):c(I2)=2:1:1时
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤??B.①④⑦??C.②⑦⑨?????D⑧⑨⑩
参考答案:C
本题解析:判断某可逆是否达到平衡的本质:1、平衡时体系中各组分的浓度保持不变;2、正、逆反应速率相等且不等于0;①错,每时每刻均这样反应;②正确;③错,平衡时不是各组分的百分含量相等而是各组分的百分含量保持不变;④错,每时每刻都是υ(H2)=υ(I2)=1/2υ(HI);⑤错,平衡时各组分的浓度可能相等也可能不相等;⑥错,该反应为等体积反应,无论是否平衡容器内压强均不变;⑦正确;⑧错,反应为等体积反应且状态都是气体,条件一定,混合气体的平均相对分子质量始终不变;⑨正确;⑩错,由于反应为等体积反应,密度为常数;
本题难度:一般