微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一容积为2 L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)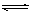 CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示:
CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示:
(1)反应处于平衡状态的时间区间是_____________。
(2)若反应进行到2 min时,改变了温度,使曲线发生如右图所示的变化,则温度为______(选填“升高”或“降低”),逆反应是____________(选填“吸”或“放”)热反应。
(3)反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示变化,该条件可能是下述中的_________________。
A.增加了C
B.增加了水蒸气
C.降低了温度
D.增加了压强
参考答案:(1)1~2 min;3~5 min?(各1分,共2 分)
本题解析:
试题分析:(1)根据图像可知,在1~2 min和3~5 min时间段内,各种物质的浓度是不再发生变化的,所以反应处于平衡状态。
(2)反应进行到2 min时,改变了温度,此时水蒸气的浓度降低,CO的浓度增加,这说明平衡向正反应方向移动。根据曲线的斜率可知,反应速率变大,所以改变的条件应该是升高温度,正方应是吸热反应,则逆反应就是放热反应。
(3)反应至5 min时,水蒸气的浓度突然变大,CO的浓度逐渐减小,而水蒸气的浓度慢慢减小,这说明改变的条件应该是增加了水蒸气的浓度,答案选B。
点评:该题是中等难度的试题,主要是考查学生对可逆反应平衡状态的熟悉了解程度,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是在明确反应特点的基础上,结合图像变化,灵活运用即可。
本题难度:一般
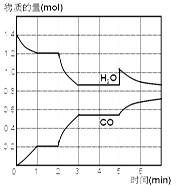
2、填空题 一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
(1)降低温度,SO2的转化率_______,化学反应速度____ 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是__?????????????????????_______。
(3)反应进行至20 min时,曲线发生变化的原因是_____????_________________(用
文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂???????????????????????? b. 缩小容器体积
c. 降低温度?????????????????????????? d. 增加SO3的物质的量
参考答案:(1) 增大,减小。(2) (15—20)min、(25—3
本题解析:(1)正反应是放热反应,所以降低温度,正逆反应速率均是减小的,平衡向正反应方向进行,所以平衡常数增大。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以根据图像可知,处于平衡状态的是15~20min,25~30min。
(3)反应进行至20 min时,氧气的浓度突然增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的条件是增大氧气的浓度;根据图像可知,10 min到15 min时,物质的浓度变化量增大,即反应速率加快,所以改变的条件是使用了催化剂或改变了压强,答案选ab。
本题难度:一般
3、选择题 在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应2A(g)+B(g) 2C(g)?△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 (???)
2C(g)?△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 (???)
A.若反应开始时容器体积为2 L,则υC=0.4mol/L·min
B.若在恒压绝热条件下反应,平衡后nC<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
参考答案:B
本题解析:
试题分析:A.若反应开始时容C的物质的量为零,则υC=0mol/L·min,错误;B.??正反应放热,若在恒压绝热条件下反应,平衡逆向移动,生成的C小于1.6 mol,故平衡后nC<1.6mol;C.反应为不等体积反应,若2min后,向容器中再投入等物质的量A、C,相当于缩小体积增加压强,平衡正向移动,B的转化率增加,错误;D.若该反应在恒温恒容下进行,相当于在恒温恒压下增大容器体积,平衡逆向移动,放出热量将减小。
本题难度:一般
4、计算题 (14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
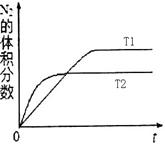
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
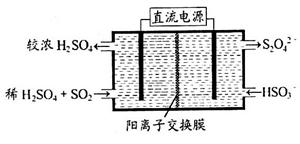
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42-互为等电子体的分子?????????????????。
参考答案:(1)① >?②0.01 mol·L-1·s-1;14.3%
本题解析:
试题分析:(1)①温度为T2时首先达到平衡状态,说明温度是T1<T2,但温度高氮气的体积分数降低,这说明升高温度平衡向正反应方向进行,因此正方应是吸热反应,即△H>0。
②50秒后达到平衡,测得NO的物质的量为2mol,则根据反应的化学方程式可知消耗氮气的物质的量是1mol,其浓度是0.5mol/L,所以该反应的速率υ(N2)=0.5mol/L÷50s=0.01 mol·L-1·s-1;平衡时氮气和氧气的浓度分别是5mol/L-0.5mol/L=4.5mol/L、2.5mol/L-0.5mol/L=2mol/L,NO的浓度是1mol/L,所以该温度下平衡常数K=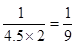 ,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则N2(g) + O2(g)
,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则N2(g) + O2(g) 2NO(g)
2NO(g)
起始浓度(mol/L)0.5??????? 0.5????????? 0
转化浓度(mol/L) x????????? x?????????? 2x
平衡浓度(mol/L)0.5-x??? 0.5-x??????? 2x
则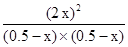 ?=
?=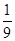 ?
?
解得x= ?
?
因此达到平衡后N2的转化率为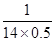 ?×100%=14.35
?×100%=14.35
(2)①电解池中阳极极失去电子,发生氧化反应,所以SO2在阳极通入,被氧化生成硫酸,电极反应式是SO2+2H2O-2e-=4H++SO42-。
②阴极排除的是S2O42-在与NO2的反应中S元素化合价从+3价升高到+4价,失去1个电子,则1molS2O42-失去2mol电子。NO2转化为无毒的气体应该是氮气,反应中氮元素化合价从+4价降低到0价,得到4个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比为1:2。
(3)根据电荷守恒可知2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),因此根据2c(Ba2+)=c(CH3COO-)可知,溶液中c(H+)=c(OH-)。根据原子守恒可知2c(Ba2+)=c(CH3COO-)=bmol/L,因此溶液中醋酸分子的浓度是0.5amol/L-bmol/L,则醋酸溶液的电离常数Ka= ?=
?= ×10-7 mol·L-1。
×10-7 mol·L-1。
(4)价电子数和原子数分别都相等的是等电子体,硫酸根中含有5个原子,32个价电子,因此与SO42-互为等电子体的分子有CCl4或CF4等。
本题难度:一般
5、选择题 某温度下,容器为2L的密闭容器中发生反应:A(g)+2B(g)?2C(g)+xD(g).起始时投入1molA和2molB,2min后达到平衡,生成1.2molD,并测得此时C的平均反应速率为0.3mol/(L?min),下列推断不正确的是( )
A.x=2
B.平衡时c(A)=0.2mol/L
C.该温度下反应的平衡常数k=11.25(mol/L)-1
D.B的反应速率也为0.3mol/(L?min)
参考答案:C的平均反应速率为0.3mol/(L?min),则2min平
本题解析:
本题难度:一般