微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.01mol/L的NH4Cl溶液中各种离子的浓度由大到小顺序为???????????????????????? ;电荷守恒关系:????????????????????????????????????????;浓度为0.01mol/L的是??????????;??????????和???????????两种粒子的浓度之和是0.01mol/L。
(2 )CH3COONa溶液中存在的2个平衡体系分别为(分别用离子方程式表示):??????????????????????????????????、????????????????????????????????????;
(3) FeCl3溶液与Na2CO3溶液混合后,反应的离子方程式为????????????????????????????????.
参考答案:(1)c(Cl-)>c(NH4+)>c(H+)&
本题解析:(1)氯化铵水解显酸性,但水解程度还是很弱的,所以离子的浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。满足电荷守恒的关系是c(H+)+ c(NH4+)= c(Cl-)+ c(OH-)。根据氮原子守恒可知NH4+和NH3.H2O两种粒子的浓度之和是0.01mol/L。因为氯离子不水解,所以氯离子的浓度也是0.01mol.L的。
(2)水溶液中一定有水的电离平衡。醋酸钠水解显碱性,所以还存在水解平衡。
(3)氯化铁水解显酸性,碳酸钠水解显碱性,所以二者的混
本题难度:一般
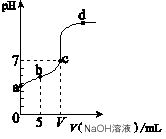
2、选择题 向10.00 mL 0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如图所示。下列说法不正确的是
 [???? ]
[???? ]
A.HA是弱酸
B.b点表示的溶液中:2c(Na+) = c(A-) + c(HA)
C.c点时:V= 10.00 mL
D.b、c、d点表示的溶液中:c(Na+) + c(H+) = c(A-) + c(OH-)
参考答案:C
本题解析:
本题难度:一般
3、选择题 25℃时,下列各项分别由等体积0.1 mol·L-1的两种溶液混合,有关混合后的溶液说法不正确的是(???)?
A.Ba(OH)2溶液与Na2SO4溶液:pH="13"
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)= c(CH3COO-)+c(OH-)
C.Na2CO3溶液与NaHCO3溶液:2c(Na+) = 3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2CO3溶液与NaOH溶液: c(Na+)>c(CO32-)>c(OH-)>c(H+)
参考答案:D
本题解析:
试题分析:D.等量Na2CO3溶液与NaOH溶液混合,考虑到碳酸根离子水解,氢氧根离子要比碳酸根离子浓度大: c(Na+)>c(OH-)>c(CO32-)>c(H+)。
本题难度:一般
4、选择题 下列物质的水溶液因发生水解而显酸性的是
A.NH4Cl
B.KHSO4
C.NaHCO3
D.H2SO4
参考答案:A
本题解析:
试题分析:A、氯化铵属于强酸弱碱盐,水解使溶液显酸性,正确;B、硫酸氢钾在水溶液中完全电离产生钾离子、氢离子、硫酸根离子而使溶液显酸性,错误;C、碳酸氢钠属于强碱弱酸盐,水解使溶液显碱性,错误;D、硫酸是强酸,完全电离使溶液显酸性,错误,答案选A。
本题难度:一般
5、选择题 在略显碱性的Na2HPO4溶液中存在着如下电离平衡:

 H++
H++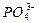 ,欲使溶液中c(
,欲使溶液中c( )、c(H+)、c(
)、c(H+)、c(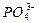 )都减小,可以采取的方法是()
)都减小,可以采取的方法是()
A.加NaOH
B.加盐酸
C.加石灰水
D.加水
参考答案:C
本题解析:加盐酸使溶液中c(H+)增大,平衡左移,c( )增大,加入NaOH会中和H+,使平衡右移,使c(
)增大,加入NaOH会中和H+,使平衡右移,使c(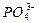 )增大,但加入Ca(
)增大,但加入Ca(
本题难度:简单