微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1克H2燃烧生成液态水,放出142.9KJ热量,则表示该反应的热化学程式正确的是( )
A.H2(g)+
1
2
O2(g)=H2O(1);△H=-285.8KJ/mol
B.2H2(g)+O2(g)=2H2O(1);△H=-142.9KJ/mol
C.2H2(g)+O2(g)=2H2O(g);△H=-571.6KJ/mol
D.2H2(g)+O2(g)=2H2O(1);△H=+571.6KJ/mol
参考答案:A
本题解析:
本题难度:一般
2、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
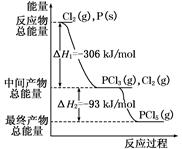
(1)P和Cl2反应生成PCl3的热化学方程式是 ;
(2)P和Cl2分两步反应生成1 mol PCl5的ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”、或“等于”)。
参考答案:(1) 本题解析:(1)产物的总能量减去反应物的总能量就等于反应热,结合图像可知,PCl3和反应物P和Cl2的能量差值为306 kJ,因此该热化学反应方程式为: 本题解析:(1)产物的总能量减去反应物的总能量就等于反应热,结合图像可知,PCl3和反应物P和Cl2的能量差值为306 kJ,因此该热化学反应方程式为:
P(s)+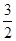 Cl2(g)=PCl3(g) ΔH=-306 kJ/mol。 Cl2(g)=PCl3(g) ΔH=-306 kJ/mol。
(2)根据盖斯定律求得:ΔH3=-399 kJ/mol,且ΔH3=ΔH4,与反应的途径无关,只与起始物质、最终物质有关。
本题难度:一般
3、选择题 已知下列热化学方程式
⑴C(s)+1/2O2(g)=CO(g) △H1="-110." 5kJ/mol
⑵2H2(g)+O2(g)=2H2O(g) △H2=-483.6 kJ·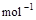
由此可知C(s)+ H2O(g) ="=" CO(g) + H2(g) ΔH3。则 ΔH3等于
A.+131.3kJ·mol-1
B.-131.3kJ·mol-1
C.+373.1kJ·mol-1
D.-373.1kJ·mol-1
参考答案:A
本题解析:
试题分析:根据盖斯定律,(1)-(2)÷2得C(s)+ H2O(g) ="=" CO(g) + H2(g),所以该反应的反应热是-110.5kJ/mol+483.6kJ/mol÷2=+131.3kJ·mol—1。
考点:考查盖斯定律的应用。
本题难度:一般
4、选择题 已知(1) 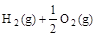 ===H2O(g) △H1=a kJ· ===H2O(g) △H1=a kJ·
(2) 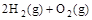 ===2H2O(g) △H2=b kJ· ===2H2O(g) △H2=b kJ·
(3) 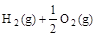 ===H2O(l) △H3=c kJ· ===H2O(l) △H3=c kJ·
(4)  ===2H2O(l) △H4=d kJ· ===2H2O(l) △H4=d kJ·
下列关系式中正确的是
A.a<c <0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:由热化学方程式的含义可知,a、b、c、d均小于0,则b=2a,d=2c;而且c<a。
本题难度:一般
5、选择题 已知:
(1)H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol
(3)H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ/mol
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是[???? ]
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般
|