微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知C(s,石墨)→C(s,金刚石)-1.9KJ,且知金刚石密度更大,则?C(s,石墨)与C(s,金刚石)的比较,正确的是( )
A.等质量时,后者能量更高更稳定
B.等质量时,前者在空气中完全燃烧放热更多
C.高温高压有利于前者转化为后者
D.前者熔化只需破坏范德华力,后者则需破坏共价键
参考答案:C(s,石墨)→C(s,金刚石)△H=1.9KJ/mol,石
本题解析:
本题难度:一般
2、填空题 随着我国人民生活水平的不断提高,家用热水器走入寻常百姓家。目前家用热水器主要有电热水器和燃气热水器两种。燃气热水器又可分为天然气型、人工煤气型和液化石油气型等。
(1)某城市人工煤气是由水煤气和焦炉煤气混合而成的。写出由焦炭制取水煤气的化学方程式____________________________________________________________________________。
(2)将40 L 20 ℃冷水加热到80℃。若使用天然气热水器,则需要标准状况下____________L 甲烷(已知22.4 L甲烷燃烧放出890.4 kJ热量,假设甲烷燃烧时的热效率为60%,水的比热为4.18 kJ·kg-1·℃-1)。若使用电热水器,则需要通电___________分钟(假设电加热棒功率为1 500 W,热效率为80%)。
(3)煤气和电都是二次能源,制煤气和火力发电都要消耗能源,且产生大气污染物,未来的新型能源是_____________________________。
参考答案:(1)C+H2O 本题解析:水煤气是碳和水蒸气在高温条件下反应生成的氢气和一氧化碳的混合物。40 L水的质量是40 kg,根据公式?Q=cmΔt有
本题解析:水煤气是碳和水蒸气在高温条件下反应生成的氢气和一氧化碳的混合物。40 L水的质量是40 kg,根据公式?Q=cmΔt有
x×890.4 kJ/22.4 L×60%="4.18" kJ·kg-1·℃-1×40 kg×(80 ℃-20 ℃),解得
x="420.7" L。 1 500×80%×t=40×4.18×103×60,解得t="8" 360,s="139.3" min。
本题难度:简单
3、选择题 下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+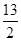 O2(g)===4CO2(g)+5H2O(l)??????ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l)??????ΔH=-2 878 kJ·mol-1
②C4H10(g)+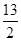 O2(g)===4CO2(g)+5H2O(g)?????ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g)?????ΔH=-2 658 kJ·mol-1
③C4H10(g)+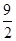 O2(g)===4CO(g)+5H2O(l)???????ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l)???????ΔH=-1 746 kJ·mol-1
④C4H10(g)+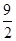 O2(g)===4CO(g)+5H2O(g)??????ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g)??????ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-2 878 kJ·mol-1
B.ΔH=-2 658 kJ·mol-1
C.ΔH=-1 746 kJ·mol-1
D.ΔH=-1 526 kJ·mol-1
参考答案:A
本题解析:
试题分析:燃烧热是在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,正丁烷生成的物质是CO2(g)和H2O(l),应用反应①计算。故A正确。
本题难度:简单
4、填空题 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:

①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 ???????移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 ???????移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1?K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正??v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: ???????????????????????????????????????.
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a?mol?L-1的氨水与b?mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式?????????????????????????????。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是???????????????????????,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI??溶液,看到的现象是????????,产生该现象的原因是(用离子方程式表示) ??????????????????????。
参考答案:(1)①?向左?????② >?, >?
(2)①N2
本题解析:
试题分析:(1)①恒温、恒压条件下,反应达平衡,向体系中通入氦气,容器的容积增大,相当于减小压???????强,平衡向气体体积增大的逆向移动,即平衡向左移动;②由图1可知,随着温度的升高,混合体系中SO3的百分含量逐渐减小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动,则该反应正向为放热反应;温度为T1<T2,则反应的平衡常数K1>K2;D点未达平衡,混合体系中SO3的百分含量小于平衡时的百分含量,反应向正反应进行,v正 >v逆;
(2)①由图2可知,N2和H2反应生?成1mol
本题难度:一般
5、选择题 下列属于放热反应的是( )
A.铝和盐酸反应
B.焦炭和二氧化碳共热
C.石灰石的分解
D.氯化铵与氢氧化钡反应
参考答案:A
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,所以答案选A。
本题难度:简单