④
实验内容

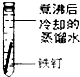
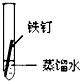
一周后观察:
(1)铁钉被腐蚀程度最大的是______(填实验序号),该实验中主要发生的是______(填“化学腐蚀”或“电化学腐蚀”),铁发生该腐蚀的条件是______.
(2)铁发生电化学腐蚀时正极的电极反应为______.
(3)为防止铁的锈蚀,工业上普遍采用的方法是______、______(答两种方法).
参考答案:(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生
本题解析:
本题难度:一般
2、选择题 在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe由+2价转为+3价???
②O2被还原、
③产生H2、
④Fe(OH)3失水形成Fe2O3-xH2O、
⑤杂质碳被氧化.
A.①②③④
B.只②③④
C.只①②
D.①②③④⑤
参考答案:钢铁生锈的过程是金属铁发生了吸氧腐蚀(或是析氢腐蚀)的原电池
本题解析:
本题难度:一般
3、填空题 (8分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
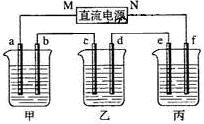
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为??????????????????????????????????;
(2)计算电极e上生成的气体在标准状态下的体积:?????????????????;
(3)电解后甲溶液的pH?????????(填“增大”、“减小”或“不变”),简述其原因:????????????????????????????????????????????????????;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
?????????????????????????????????????????? ?????????????????。
参考答案:
(1)4OH--4e-=2H2O + O2↑(2分)
本题解析:(1)乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。
(2)当乙中有16gCu析出时,转移的电子为0.5mol。而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。丙中为K2SO4,相当于电解水,由方程式2H2O 本题难度:一般 本题难度:一般
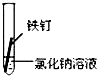
4、填空题 (9分) 右图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的 腐蚀属于???????????腐蚀。(填化学腐蚀或电化学腐蚀) 腐蚀属于???????????腐蚀。(填化学腐蚀或电化学腐蚀)
(2)若试管内液面上升,则原溶液呈??????????????性,发生????????????腐蚀,正极反应式为????????????????????????。
(3)若试管内液面下降,则原溶液呈???????????性,发生????????????腐蚀,正极反应式为???????????????????????。
参考答案:(1)电化学(1分)
(2)弱酸性或中(1分);吸氧(
本题解析:略
本题难度:简单
5、选择题 下列说法不正确的是??? ( )
A.粗铜电解精炼时,应将粗铜与直流电源的正极相连
B.金属的吸氧腐蚀的过程中,正极的电极反应式为O2+2H2O+4e-=4OH-
C.燃料电池中加入燃料的电极一定是电池的负极
D.在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连
参考答案:D
本题解析:钢铁与电源的正极相连时作阳极,会失电子而被氧化腐蚀,D错。
本题难度:一般
|