微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在离子浓度都为0.1?mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32—
C.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32—
D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
2、选择题 对于在一定条件下进行的化学反应,改变下列条件,可以提高反应物中的活化分子百分数的是
①升高温度??????②加入催化剂???③增大体系压强??④增大反应物浓度
A.①②
B.②③
C.③④
D.①④
3、选择题 已知空气—锌电池的电极反应为
锌片:Zn+2OH--2e-=ZnO+H2O?????石墨:O2+2H2O+4e-=4OH-
根据此判断,锌片是:
A.负极,并被氧化
B.负极,并被还原
C.正极,并被氧化
D.正极,并被还原
4、选择题 C4H9Cl的同分异构体的个数是
A.2
B.3
C.4
D.5
5、填空题 (12分)工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下:
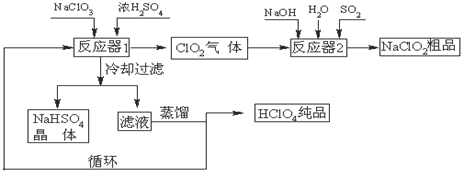
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。