微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在离子浓度都为0.1?mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32—
C.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32—
D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
参考答案:C
本题解析:
本题难度:困难
2、选择题 对于在一定条件下进行的化学反应,改变下列条件,可以提高反应物中的活化分子百分数的是
①升高温度??????②加入催化剂???③增大体系压强??④增大反应物浓度
A.①②
B.②③
C.③④
D.①④
参考答案:A
本题解析:考查外界条件对反应速率的影响。升高温度或使用催化剂,可以提高反应物中的活化分子百分数。而增大反应物浓度或增大压强,增加的是单位体积内活化分子百分数,所以正确的答案选A。
本题难度:困难
3、选择题 已知空气—锌电池的电极反应为
锌片:Zn+2OH--2e-=ZnO+H2O?????石墨:O2+2H2O+4e-=4OH-
根据此判断,锌片是:
A.负极,并被氧化
B.负极,并被还原
C.正极,并被氧化
D.正极,并被还原
参考答案:A
本题解析:试题分析:锌失去电子,发生氧化反应,所以锌是负极,答案选A。
考点:考查原电池的有关判断
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。
本题难度:一般
4、选择题 C4H9Cl的同分异构体的个数是
A.2
B.3
C.4
D.5
参考答案:C
本题解析:C4H9Cl可以看作是丁烷中的1个氢原子被氯原子取代。由于丁烷有2种同分异构体,正丁烷和异丁烷,且这两种同分异构体都含有2种氢原子,所以共计是4种,答案选C。
本题难度:困难
5、填空题 (12分)工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下:
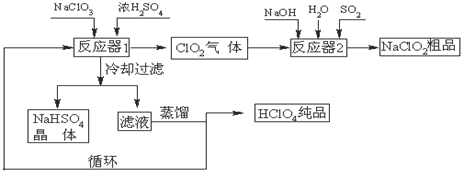
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
参考答案:(每空2分,共12分) (1)溶解度 (2)2Cl
本题解析:
试题分析:(1)在反应器1中,硫酸钠和硫酸反应得到硫酸氢钠。冷却过滤可以得到硫酸氢钠晶体,这说明冷却过滤的目的是降低NaHSO4的溶解度,并分离出NaHSO4晶体。
(2)SO2具有还原性,在碱性溶液中能把ClO2还原为NaClO2,反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)根据反应2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O可知,氯酸钠中氯元素的化合价从+5价降低到+4价,得到1个电子,ClO2是还原产物。亚硫酸钠中S元素的化合价从+4价升高到+6价,失去2个电子,硫酸钠是氧化产物。根据电子得失守恒可知,氧化产物与还原产物的物质的量之比为1:2;
(4)根据题意高氯酸的沸点为90C,沸点比较低,因此可以采用蒸馏滤液的方法得到高氯酸。根据流程图可知现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,因此硫酸可以循环使用。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
[-page -]
1、选择题 原电池
A.把光能转化为化学能
B.把化学能转化为光能
C.把热能转化为电能
D.把化学能转化为电能
2、选择题 在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H2
B.CO2→CO
C.Fe2O3→Fe
D.Br-→Br2
3、选择题 氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于置换反应
D.生成1molN2有12mol电子转移
4、选择题 下列各组物质中,不能发生离子反应的是
A.K2CO3溶液与盐酸
B.稀硫酸与BaCl2溶液
C.KNO3溶液与NaOH溶液
D.NaOH溶液与硝酸溶液
5、选择题 在常温常压下,下列各组气体不能共存的是
A.SO2与O2
B.NO与O2
C.O2与N2
D.NO2与NO