微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol/L的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答:
①实验中,需要的仪器有(填序号) ,还缺少的仪器有(填名称)
A托盘天平(带砝码、镊子) B滴定管 C 100mL的量筒 D、100mL的容量瓶
E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒 I、药匙 J、烧瓶
②实验中,标准KMnO4溶液应装在 式滴定管中,因为
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会 (填偏大、偏小、无影响)。
④在滴定过程中若用去amol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L,由此,x= 。
⑤若滴定终点读数时俯视刻度,则计算的x值会 (填偏大、偏小、无影响)。
参考答案:①A、B、D、E、G、H、I ,胶头滴管、铁架台带滴定管夹
本题解析:
试题分析:①根据配制溶液需要的仪器可知:在该实验中,需要的仪器有A、B、D、E、G、H、I ,还缺少的仪器有胶头滴管、铁架台带滴定管夹;②实验中,标准KMnO4溶液因为有强氧化性,会腐蚀橡胶管,所以应该应装在酸式滴定管中,③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,因为锥形瓶中物质的质量等都没有变化,所以则所测得的x的值会无任何影响;④根据反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知:n(H2C2O4)= 5/2n(KMnO4) 。n(KMnO4)= aV×10-3mol,0.025L×c(H2C2O4)= 5/2×aV×10-3,解得c(H2C2O4)=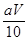 mol/L。则[Wg÷(90+18x)g/mol]÷4=
mol/L。则[Wg÷(90+18x)g/mol]÷4=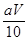 ×0.025mol,解得x=
×0.025mol,解得x=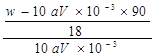 或者
或者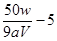 ;⑤若滴定终点读数时俯视刻度,则草酸的物质的量偏少,计算的x值会偏大。
;⑤若滴定终点读数时俯视刻度,则草酸的物质的量偏少,计算的x值会偏大。
考点:考查物质的量浓度的溶液的配制、滴定法在测定物质的浓度积物质组成中的应用的知识。
本题难度:一般
2、填空题 写出下列反应的化学方程式:
(1)食品疏松剂中含有的碳酸氢钠在蒸煮时受热分解
(2)淀粉在人体消化道中转化为葡萄糖.
参考答案:(1)碳酸氢盐受热易分解为碳酸盐、水和二氧化碳,即2NaHC
本题解析:
本题难度:一般
3、选择题 下列化学用语表示正确的是(???)
A.食盐中阴离子的结构示意图为: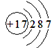
B.硫酸氢钠溶液的电离方程式:NaHSO4=Na++H++SO42-
C.三氟化氮的电子式: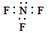
D.乙醇分子比例模型: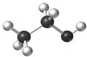
参考答案:B
本题解析:
试题分析:氯离子的最外层电子数是8个,A不正确;C不正确,因为F原子还有6个电子没有参与成键,电子式应该是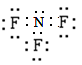 ;D不正确,所给模型应该是球棍模型,所以正确的答案选B。
;D不正确,所给模型应该是球棍模型,所以正确的答案选B。
本题难度:一般
4、选择题 下列说法正确的是
A.由于H2O分子内存在氢键,所以H2O比H2S稳定
B.11.2 L O2和CO2的混合气体中含有6.02×1023个氧原子
C.固态NaCl不导电,是由于NaCl晶体中不存在阴、阳离子
D.可逆反应达平衡状态后,化学反应速率发生变化,平衡不一定移动
参考答案:D
本题解析:
试题分析:A选项H2O比H2S稳定,是由化合物的键能决定的,由于H2O分子内存在氢键,所以H2O的沸点比H2S的大,氢键不会影响物质的稳定性。B 选项必须强调是在标准状况下才行。C选项固态的
NaCl不导电,是由于NaCl晶体中不存在自由移动的阴、阳离子,而不是没有阴、阳离子。D选项反应达到平衡后加正催化剂,化学反应速率加快,但平衡未发生移动,故D正确。
点评:本题涉及到的知识点较多,对于每个选项,需要用到不同的化学原理来进行判断,学生需要对基础知识的掌握熟练。
本题难度:一般
5、选择题 Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
A.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
B.Na2FeO4既是氧化产物又是还原产物
C.Na2O2在上述反应中只作氧化剂
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
参考答案:C
本题解析:
试题分析:根据题给反应判断,反应中FeSO4中铁元素的化合价由+2价升高到+3价,Na2O2中氧元素的化合价既升高又降低。A、Na2FeO4处理水时,Na2FeO4具有强氧化性能杀菌,其还原产物氢氧化铁又能在处理水时产生胶体净水,正确;B、反应中FeSO4→Na2FeO4,铁元素的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,氧元素化合价降低,Na2FeO4是还原产物,正确; C、Na2O2中氧元素的化合价既升高又降低,既作氧化剂又作还原剂,错误;D、反应中化合价升高的元素有Fe,由+2价→+6价,氧元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,正确。
考点:考查氧化还原反应基本概念。
本题难度:一般