微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组混合物中,能用分液漏斗进行分离的是
A.苯和CCl4
B.溴和CCl4
C.酒精和水
D.汽油和水
参考答案:D
本题解析:
试题分析:A、苯和四氯化碳互溶,不能用分液漏斗进行分离,A不正确;B、溴单质易溶在有机溶剂中,不能用分液漏斗进行分离;C、酒精与水互溶,不能用分液漏斗进行分离;D、汽油不溶于水,在水的上层,可以用分液漏斗进行分离,D正确,答案选D。
本题难度:简单
2、填空题 用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下:
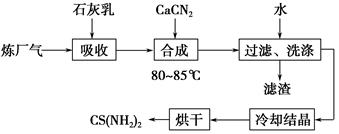
(1)高温下,H2S存在下列反应:2H2S(g)??2H2(g)+S2(g),其平衡常数表达式为K=________________。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是_____________________________________________________;
过滤得到的滤渣可再利用,滤渣的主要成分是________(填化学式)。
(3)合成硫脲需长时间搅拌,并在较高温度(80~85 ℃)下进行,其目的是_______________________________________。
Ca(HS)2与CaCN2在水溶液中合成硫脲的化学方程式为________________________________。
(4)化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为________________。
参考答案:(1)  本题解析:(1)该反应的反应物和生成物均为气体,K的表达式为生成物浓度的次方除以反应物浓度的次方。(2)气体在水中的溶解度随着温度的升高而减小。石灰乳中Ca(OH)2的浓度较大,吸收H2S后,一般仍有剩余,可以再利用。(3)接触面积大,温度高均可以提高反应速率。由(2)的提示知,石灰乳吸收H2S生成Ca(HS)2进入“合成”阶段,箭头指入为加入反应物,则CaCN2和H2O均为反应物,由元素守恒知,生成CS(NH2)2外还有Ca(OH)2。(4)某溶液遇FeCl3溶液,溶液显红色,则该溶液中含有SCN-,互为同分异构体的两种化合物化学式相同,由原子种类和数目可以确定还有NH4+,则为NH4SCN。
本题解析:(1)该反应的反应物和生成物均为气体,K的表达式为生成物浓度的次方除以反应物浓度的次方。(2)气体在水中的溶解度随着温度的升高而减小。石灰乳中Ca(OH)2的浓度较大,吸收H2S后,一般仍有剩余,可以再利用。(3)接触面积大,温度高均可以提高反应速率。由(2)的提示知,石灰乳吸收H2S生成Ca(HS)2进入“合成”阶段,箭头指入为加入反应物,则CaCN2和H2O均为反应物,由元素守恒知,生成CS(NH2)2外还有Ca(OH)2。(4)某溶液遇FeCl3溶液,溶液显红色,则该溶液中含有SCN-,互为同分异构体的两种化合物化学式相同,由原子种类和数目可以确定还有NH4+,则为NH4SCN。
本题难度:一般
3、填空题 锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
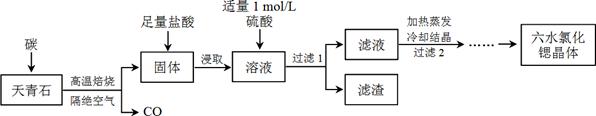
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
参考答案:(1)天青石焙烧前先研磨粉碎,其目的是为了增加反应物的接触面
本题解析:
试题分析:(1)天青石焙烧前先研磨粉碎,其目的是为了增加反应物的接触面积,提高化学反应速率,从而提高原料的转化率。(2)在焙烧的过程中若只有0.5 mol SrSO4中只有S被还原,转移了4 mol电子,则1mol的S转移8mol的电子,由于在反应前元素的化合价为+6价,所以反应后元素的化合价为-2价。因此碳与天青石在高温下发生反应SrSO4 + 4C SrS + 4CO↑,(3)然后向得到的含有SrS固体中加入HCl发生反应:SrS+2HCl= SrCl2+H2S↑,将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即SrCl2·6H2O。(4)在用HCl溶解SrS后的溶液中加入硫酸的目的是除去溶液中Ba2+杂质。由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10;所以c(SO42-)=1.1×10-10÷1×10-5=1.1×10-5mol/L。而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=3.3×10-7÷1.1×10-5=3.0×10-2=0.03mol/L。(5)若NH4SCN不再剩余的Ag+ 结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色。因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色。n(NH4SCN)="0.2000" mol/L×0.02L=4.0×10-3mol,所以溶液中剩余的Ag+的物质的量为n(Ag+)=4.0×10-3mol,因此与Cl―反应的Ag+的物质的量为n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol n(SrCl2·6H2O)=3.5×10-3mol,m(SrCl2·6H2O)= 3.5×10-3mol×267 g/mol=0.9345g.所以产品纯度为0.9345g÷1g×100%=93.45%.
SrS + 4CO↑,(3)然后向得到的含有SrS固体中加入HCl发生反应:SrS+2HCl= SrCl2+H2S↑,将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即SrCl2·6H2O。(4)在用HCl溶解SrS后的溶液中加入硫酸的目的是除去溶液中Ba2+杂质。由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10;所以c(SO42-)=1.1×10-10÷1×10-5=1.1×10-5mol/L。而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=3.3×10-7÷1.1×10-5=3.0×10-2=0.03mol/L。(5)若NH4SCN不再剩余的Ag+ 结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色。因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色。n(NH4SCN)="0.2000" mol/L×0.02L=4.0×10-3mol,所以溶液中剩余的Ag+的物质的量为n(Ag+)=4.0×10-3mol,因此与Cl―反应的Ag+的物质的量为n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol n(SrCl2·6H2O)=3.5×10-3mol,m(SrCl2·6H2O)= 3.5×10-3mol×267 g/mol=0.9345g.所以产品纯度为0.9345g÷1g×100%=93.45%.
本题难度:一般
4、选择题 欲从苯酚的乙醇溶液中回收苯酚,有下列操作:
①蒸馏
②过滤
③静置、分液
④加入足量金属钠
⑤通入过量的CO2
⑥加入足量的NaOH溶液
⑦加入足量的FeCl3溶液
⑧加入乙酸与浓硫酸混合物,加热。
合理的实验程序是[???? ]
A.④⑤③
B.⑥①⑤③
C.⑧①
D.⑧②⑤③
参考答案:B
本题解析:
本题难度:一般
5、实验题 (8分)用适当方法将下列混合物分离开来
(1)不溶性固体与水的混合物,如CaCO3与水,可用_______ 方法分离
(2)两种互相溶解但沸点相差较大的液体,如苯和四氯化碳的混合物,可用_______ 方法分离
(3)可溶性固体与水的混合物。如食盐和水,可用_______ 方法分离
(4)两种互不相溶的液体,如水和油,可用_______ 方法分离
参考答案:过滤,蒸馏,蒸发,分液
本题解析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法。
(1)碳酸钙不溶于水,过滤即可。
(2)两种互相溶解但沸点相差较大的液体,可用蒸馏的方法分离。
(3)可溶性固体与水的混合物的分离可用蒸发的方法分离。
(4)两种互不相溶的液体的分离,可用分液的方法分离。
本题难度:一般