微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是???????????????????;实验室在配制FeSO4溶液时常加入???????以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化??????????????????????????????。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是?????????????????????????????????????????????。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
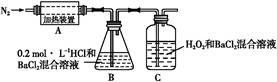
①A中固体充分加热较长时间后,通入氮气,目的是????????????????????????????????。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为??????????????????????。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为????????(用离子方程式表示)。
参考答案:Ⅰ.(1)12Fe2++3O2+6H2O=Fe(OH)3↓+
本题解析:(1)Fe2+被O2氧化为Fe3+,最终生成红褐色的Fe(OH)3沉淀;加入铁粉可以防止Fe2+被氧化为Fe3+;通常用KSCN检验Fe3+。
(2)N 水解显酸性,c(H+)越大,反应4Fe2++O2+10H2O=Fe(OH)3↓+8H+正向进行的程度越小,Fe2+越不易被氧化。
水解显酸性,c(H+)越大,反应4Fe2++O2+10H2O=Fe(OH)3↓+8H+正向进行的程度越小,Fe2+越不易被氧化。
(3)①通入N2可
本题难度:一般
2、选择题 某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是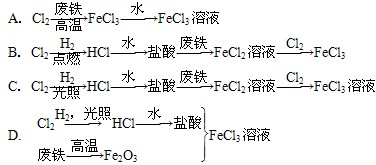
参考答案:B
本题解析:A错,高温需要消耗能源;C错,氢气和氯气光照容易发生爆炸;D错,高温要消耗大量能源;
本题难度:一般
3、选择题 部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是(? )。
A.滤液A中的阳离子为Fe3+、Fe2+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
参考答案:B
本题解析:根据题意,3.2 g滤渣一定是铜,而铜与Fe3+不共存,则A项错误;最后的3.2 g固体为Fe2O3,其中Fe元素的质量为2.24 g,B正确;样品中Cu元素和O元素共5.76 g-2.24 g=3.52 g,则C项错误;因2.24 g Fe元素已部分氧化,且Fe还与Fe3+、Cu2+发生反应,故生成的氢气的体积应小于896 mL,D错误。
本题难度:一般
4、选择题 .取含有Fe2O3杂质的铁粉100g,投入过量的盐酸中,产生H2标准状况下31.36L,在反应后的溶液中加入KSCN溶液,没有红色产生,问样品中杂质含量(????)
A??? 4%???? B??? 32%????? C?? 8%???????? D? 16%
参考答案:D
本题解析:氢气是1.4mol,所以和盐酸反应生成氢气的铁是1.4mol。设氧化铁的物质的量是x,则氯化铁就是2x,所以和氯化铁反应的铁是x,因此有160x+(x+1.4)×56=100,解得x=0.1mol,所以杂的含量是160x÷100,即16%,答案选D。
本题难度:一般
5、填空题 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为????????。若要提高FeSO4生成速率,采取下列措施中正确的是????????。
A.使用浓硫酸与铁屑反应???
B.使用磨细的铁粉反应
C.控制温度在50~70℃?????
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+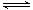 4Fe3++2H2O?
4Fe3++2H2O?
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是????????。
A.控制稀硫酸的浓度不能太高?????
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1???
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行??????????、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:
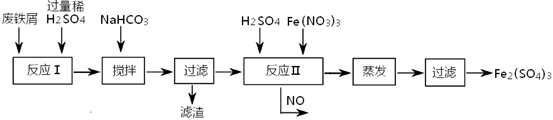
①加入NaHCO3并搅拌,将混合液pH调控至???????范围内,使杂质沉淀过滤除去。
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| Cu(OH)2
|
开始沉淀
| 2.3
| 7.5
| 3.4
| 4.7
|
完全沉淀
| 3.2
| 9.7
| 4.4
| 6.7
?
②反应Ⅱ中反应的离子方程式是:???????????。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是???????,气体X与NO配比的比例是???????。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是?????????。
参考答案:(1)①? Fe+2H+=Fe2++H2↑???? B、C?
本题解析:
试题分析:(1)铁和氢离子发生置换反应制备硫酸亚铁,可以使用铁粉增大接触面积,加快速率,B正确;但是不能用浓硫酸,铁在常温条件下遇浓硫酸钝化,A错误;硫酸亚铁在60℃时溶解度高,所以选择温度在50~70℃,C正确,D错误。减少Fe2+被氧化,控制硫酸浓度,减少H+浓度,平衡逆向移动,A正确,B、稀释浓硫酸应该把硫酸向水中加,并不断搅拌,错误;C、铁过量可以防止Fe2+被氧化,正确;D、加入Fe3+将会增加Fe3+浓度,错误。反应结束后,过滤除去过量的铁,再降低温度,硫酸亚铁的溶解度减小,析出晶体。
本题难度:困难
|