0.120
(1)该反应的平衡常数表达式为______________________;
从表中分析:c1________c2;c3________c4(填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线。
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__????????mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是????
A.增大容器的容积 ???????????????????????????? B.再充入一定量的N2O4
C.分离出一定量的NO2????????????????????????????? D.再充入一定量的He
参考答案:(13分) (1)K= 本题解析:】(1)N2O4???? 本题解析:】(1)N2O4???? ????2NO2 ????2NO2
初n:???????? 0.10??????????? 0
20s:???????? 0.07?????????? 0.06
40s????????? 0.05?????????? 0.10
60s:???????? 0.04?????????? 0.12
80s:???????? 0.04??????????? 0.12
(3)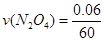 =0.001 mol/(L·s) =0.001 mol/(L·s)
(4)增大容器的容积,各物质浓度均减少,虽然平衡略向右移,但NO2气体的浓度相对原平衡仍然是减小;而在题设条件下,恒容,分离出一定量的NO2,其浓度减少,虽然平衡略向右移,但NO2气体的浓度相对原平衡仍然是减小;再充入一定量的He,各物质浓度不变,平衡不移动;再充入一定量的N2O4,平衡正向移动,NO2气体的浓度增大,符合题意。
本题难度:一般
3、选择题 t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示: 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是
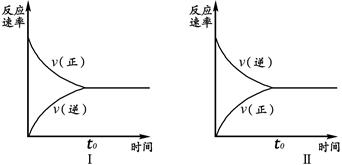
A.若实验ⅠSO?2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L.
B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。
C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。
D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。
参考答案:D
本题解析:
试题分析:从实验Ⅰ中起初V(逆)为0,说明只有反应物,没有生成物,而实验Ⅱ中起初V(正)为0,说明只有生成应物,没有反应物.数据分析发现:达到平衡时,化学状态和化学状态二完全相同,也就是等温和等容条件下的等效平衡。由于图Ⅱ中隐含一个条件,只有产物,达到平衡时,C(SO2): C(O2)=2:1。SO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L,在定T、V条件下,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量与原平衡相同,则二平衡等效,即实验ⅡSO3的起始浓度为1mol/L。恒温恒容下分别进行下列两种操作SO2的转化率+SO3的转化率=1,实验ⅡSO3的转化率为1-a%;若起始浓度C(SO2)=" m" mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同即m/n =" 2" 和 m+p="1;" 改密闭刚性容器为密闭可变体积容器(等压容器)相当于在原来平衡的基础上加压,则加压平衡向正反应方向移动,速率(正逆)变大
点评:本题在掌握化学平衡的相关知识的同时,还应该注意看懂图像,作答时,应该注重图像与知识的结合。难度较大。
本题难度:简单
4、填空题 (10分)现有T1℃的密闭容器中存在如下反应:2SO2 (g) + O2(g)  2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断: 2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,理由是???????????????????;若未达到,反应向??????????进行。(填“正反应”或“逆反应”)
(2)已知T2>T1,则该反应T2℃下的平衡常数________19。(填“>”“<”或“=”)
(3)达平衡状态时, SO2的转化率α应为???????????(列出与α有关的计算公式即可)
参考答案:(1)没有达到平衡因为浓度商Qc=1.1≠19,所以未达到平
本题解析:考查可逆反应的有关计算。
(1)当SO2转化率为50%时,生成三氧化硫是0.4mol/L×0.5=0.2mol/L,剩余SO2和氧气扥的分别是是0.2mol/L和0.9mol/L,则此时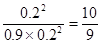 <19,所以该反应还没有达到平衡状态,此时正反应速率大于逆反应速率,因此反应向正反应方向进行。 <19,所以该反应还没有达到平衡状态,此时正反应速率大于逆反应速率,因此反应向正反应方向进行。
(2)正反应是放热反应,所以升高温度平衡向逆反应方向进行,则平衡常数是减小的。
(3)????????????2SO2 (g) + O2(g)  2SO3(g) 2SO3(g)
起始浓度(mol/L)? 0.4????? 1.0??????? 0
转化浓度(mol/L)? 0.4α???? 0.2α?????? 0.4α
平衡浓度(mol/L) 0.4-0.4α? 1.0-0.2α? 0.4α
所以根据平衡常数的表达式可知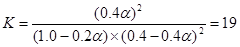 。 。
本题难度:一般
5、选择题 在容积可变的密闭容器中,2molA和8molB在一定条件下发生反应:A+3B 2C,达到平衡时,B的转化率为25%,则平衡时A的体积分数接近于[???? ] 2C,达到平衡时,B的转化率为25%,则平衡时A的体积分数接近于[???? ]
A.5%????
B.10%????
C.15%????
D.20%
参考答案:C
本题解析:
本题难度:一般
|