????主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
(1)碱性最强的化合物的电子式是:______.
(2)写出④的最高价氧化物的水化物和⑦的最高价氧化物的水化物反应的离子方程式______
(3)用电子式表示元素④与⑥的化合物的形成过程:______,该化合物属于______(填“共价”或“离子”)化合物.
参考答案:(1)碱性最强的元素对应的金属的金属性最强,应为④,即K元素
本题解析:
本题难度:一般
4、填空题 (1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。?
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 。?
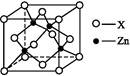
③如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。?
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为140~145 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。?
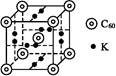
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如右图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。?
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。?
参考答案:(1)①四 ⅡB ds ②sp3杂化 1s22s22p3 ③
本题解析:(1)①从K开始数数到Zn为12,核外电子排布式[Ar]3d104s2;③晶胞中含有X的个数=8×+6×=4,Zn的个数为4;结合Zn和X通过共价键结合可知该晶体属于原子晶体;(2)③Si最外层电子数为4,与3个硅原子形成3个σ键,还余1个电子与3个硅原子其中的一个形成π键,所以一个硅原子形成的π键为个,一个Si60分子中含有60个Si原子形成30个π键
本题难度:一般
5、选择题 下列化学用语书写正确的是( )
A.明矾的化学式为KAlSO4?12H2O
B.氯离子的结构示意图为: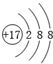
C.硫酸的电离方程式:H2SO4═H2++SO42-
D.纯碱的化学式:NaCO3
参考答案:A.明矾中含有2个硫酸根离子,明矾的化学式为KAl(SO4)
本题解析:
本题难度:一般
|