微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)SO2、NO是大气污染物。工业上吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
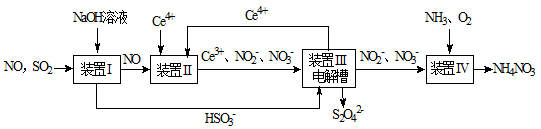
(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅲ中,电解槽的阳极发生的电极反应为 ;
(4)从装置Ⅳ中获得粗产品NH4NO3的实验操作依次为 、 、过滤、洗涤等。
参考答案:(8分)
(1)SO2 + OH-="=" HSO3-
本题解析:
试题分析:(1)过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢根离子,离子方程式为SO2 + OH-="=" HSO3-;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,是因为亚硫酸氢钠溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="=" CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="=" CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
(3)根据流程图可知,装置III电解槽中的硝酸根离子、亚硝酸根离子未变化,亚硫酸氢根离子变为S2O42-,S的化合价降低,Ce3+变为Ce4+,Ce的化合价升高,所以阳极发生的反应是Ce3+ - e— ="=" Ce4+;
(4)从溶液中得到晶体的操作是蒸发浓缩、冷却结晶,然后过滤、洗涤得到产品。
考点:考查对流程图的分析,溶液中的平衡应用,电化学反应原理,基本操作的判断
本题难度:困难
2、选择题 下列说法正确的是
A.常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1
B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同
C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1
参考答案:B
本题解析:
试题分析:A、,PH=9的碳酸钠溶液中c(H+)=1×10-9mol·L-1,则c(OH-)=1×10-5mol·L-1,因为氢离子被碳酸根离子结合生成碳酸氢根离子,所以溶液中的氢离子浓度小于氢氧根离子浓度,而氢氧根离子来自水的电离,所以由水电离出的c(OH-)= 1×10-5mol·L-1,错误;B、水的离子积常数是温度常数,只随温度变化,所以温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同,正确;C、若所有离子浓度均降低,则c(H+)·c(OH-)将减小,这与温度不变时水的离子积是
本题难度:一般
3、选择题 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L 盐酸和20.00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。 若以HA表示酸,下列说法正确的是
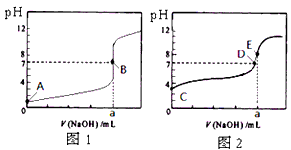
[???? ]
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+) = c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-) >c(Na+)> c(H+) > c(OH-)
参考答案:B
本题解析:
本题难度:一般
4、选择题 欲使0.1 mol·L-1NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少的方法是 [???? ]
A. 通入二氧化碳气体
B. 加入NaOH固体
C. 通入HCl气体
D. 加入饱和石灰水
参考答案:D
本题解析:
本题难度:一般
5、选择题 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是
 ?
?
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:c<a<b
C.若用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
参考答案:C
本题解析:
试题分析:导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故A错误;随水的增多,醋酸的电离程度在增大,所以a、b、c三点醋酸的电离程度:a<b<c,故B错误;用湿润的pH试纸测量a处溶液的pH,有图可以看出其pH应该是变小,故测量结果偏小,所以C正确,为本题的正确答案;a、b、c三点溶液pH不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故D错误,所以本题的答案选C。
点评:本题
本题难度:简单