微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将浓度为0.1 mol/L Na2CO3溶液加水稀释,下列结论错误的是(???)
A.水解平衡正向移动
B.各微粒浓度均变小(除H2O外)
C.溶液中离子数目增多
D.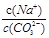 比值增大
比值增大
参考答案:B
本题解析:CO32—+ H2O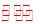 ? HCO3- + OH—水解平衡加水稀释向右移动,溶液体积增大,所以OH—浓度变小,当然H+浓度要增大,故B错;ACD正确;答案为B
? HCO3- + OH—水解平衡加水稀释向右移动,溶液体积增大,所以OH—浓度变小,当然H+浓度要增大,故B错;ACD正确;答案为B
本题难度:一般
2、选择题 下列溶液中各微粒的浓度关系正确的是
A.pH=4的盐酸中:c(H+)=4.0mol·L-1
B.NH4Cl溶液中:c(Cl-)=c(NH4+)
C.NaCl溶液中:c(Na+) + c(H+)= c(Cl-)+c(OH-)
D.NaHCO3溶液中:c(HCO3-)+c(H2CO3)+ c(CO32-) =c(Na+)
参考答案:CD
本题解析:
试题分析:A、氢离子浓度的负对数就是pH,因此pH=4的盐酸中c(H+)=0.0001mol·L-1,A不正确;B、氯化铵是强酸弱碱盐,NH4+水解,溶液显酸性,因此氯化铵溶液中c(Cl-)>c(NH4+),B不正确;C、根据电荷守恒可知,氯化钠溶液中c(Na+) + c(H+)= c(Cl-)+c(OH-),C正确;D、根据物料守恒可知NaHCO3溶液中c(HCO3-)+c(H2CO3)+ c(CO32-) =c(Na+),D正确,答案选CD。
本题难度:一般
3、选择题 在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,下列关系式中正确的是 (???? )
A.c(Na+) = c(CH3COO-)+c(CH3COOH)
B.c(H+) = c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,因为碱中c(OH-)与酸中c(H+)相等,等体积混合后,因CH3COOH是弱酸,会大量的剩余,所以反应后溶液显酸性,c(H+)>c(OH-),C错。反应后的溶质为大量的CH3COOH,少量的CH3COONa。所以c(Na+) <c(CH3COO-)+c(CH3COOH),A错。根据电荷守恒得c(Na+) +
本题难度:一般
4、选择题 常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
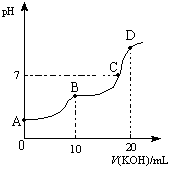
A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<
c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+ c(HC2O4-)+ c(H2C2O4)= c(OH-)
参考答案:BC
本题解析:
试题分析:在曲线的B点处反应恰好生成KHC2O4,溶液为酸性,HC2O4-以电离为主,故有c(K+)>c(HC2O4-)>c(H+)>c(OH-),A错误B正确;在曲线的D点恰好反应生成K2C2O4,质子守恒式为c(H+)+ c(HC2O4-)+ 2c(H2C2O4)= c(OH-),故D错误;C点溶液为中性,K2C2O4含有少量KHC2O4,有c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+),电荷守恒为c(K+)=c(HC2O4-)+2c(C2O42-)( c(H+)= c
本题难度:一般
5、选择题 下列各溶液中,微粒物质的量浓度关系正确的是( )
A. 溶液中
溶液中
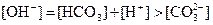
B.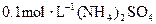 溶液中:
溶液中:
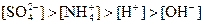
C.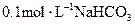 溶液中:
溶液中:
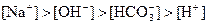
D.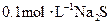 溶液中:
溶液中:
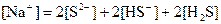
参考答案:D
本题解析:利用原子守恒和电荷守恒是解决这一问题的有效办法.
本题难度:一般