微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是(???)
A.NaHCO3溶液中:c(H+) + c(H2CO3) = c(CO32?) + c(OH?)
B.NaHCO3溶液与NaOH溶液混合时,反应的离子方程式为:HCO3?+ OH?= CO2↑ + H2O
C.0.2mol·L?1 HCl溶液与等体积0.05 mol·L?1 Ba(OH)2溶液混合后,溶液的pH=1
D.无色透明的酸性溶液中,Fe3+、K+、SO42?、NO3?能大量共存
参考答案:A
本题解析:A:该溶液中电荷守恒为:c(H+)+ c(Na+)= 2c(CO32?)+c(OH?)+c(HCO3?),碳与钠元素的物料守恒为: c(Na+)=c(CO32?)+c(H2CO3)+c(HCO3?),将后式代前上式,可得到:c(H+) + c(H2CO3) = c(CO32?) + c(OH?),正确
B:离子方程式为:HCO3?+ OH?= CO32? + H2O,不正确
C:混合后,H+过量, 本题难度:一般
本题难度:一般
2、填空题 (4分)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生碱性的原因:??????????????????????????????,及用石膏降低其碱性的反应原理:????????????????????????????????????????。
参考答案:(4分) Na2CO3 + H2O= NaOH+NaHCO3
本题解析:
试题分析:碳酸钠是强碱弱酸盐,溶于水水解显碱性,水解方程式是Na2CO3 + H2O= NaOH+NaHCO3;石膏是硫酸钙,能和碳酸钠反应生成难溶性的碳酸钙沉淀,从而抑制水解,反应的化学方程式是Na2CO3 +CaSO4= Na2SO4+CaCO3↓。
点评:本题关键是要从平衡的角度去理解如何降低溶液的酸碱性,因此要利用勒夏特例原理。
本题难度:简单
3、选择题 下列说法正确的是???
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO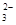 )之比为2:1
)之比为2:1
C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1
D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,两者恰好反应C(SO42-)=0
参考答案:A
本题解析:考查溶液的酸碱、pH的概念
A.正确
B.由于CO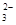 部分水解,所以溶液中c(Na+)与c(CO
部分水解,所以溶液中c(Na+)与c(CO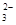 )之比大于
)之比大于
本题难度:一般
4、选择题 常温下PH=2的A酸溶液和PH=12的B碱溶液等体积混合后,溶液的PH一定小于7,则A、B可能为(??? )
A.强酸、强碱???? B.弱酸、弱碱??? C.强酸、弱碱?? D.弱酸、强碱?
参考答案:D
本题解析:若为强酸、强碱,则混合后溶液的PH应=7;
要求混合后溶液的PH小于7,则余酸,所以:A、B可能为弱酸、强碱
本题难度:一般
5、填空题 常温下有浓度均为0.5 mol·L-1的四种溶液:①碳酸钠溶液②碳酸氢钠溶液③盐酸④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是___________(填序号,下同),在发生水解反应的溶液中pH最大的是____________________。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是____________________。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中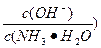 的值_________(填“增大”“减小”或“不变”)。
的值_________(填“增大”“减小”或“不变”)。
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是___________。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=______________。
参考答案:(1)①②?①?? (2)②?? (3)减小
(4)c
本题解析:(2)既能与氢氧化钠溶液反应,又能与硫酸溶液反应的物质有弱酸的酸式盐、弱酸的铵盐、铝、氢氧化铝、氧化铝等。(3)加入少量氯化铵固体,使NH3·H2O
 本题难度:简单
本题难度:简单