微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数的值,下列说法错误的是
A.高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA;
B.MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA;
C.5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA;
D.5NH4NO3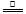 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA。
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA。
参考答案:C
本题解析:
试题分析:根据化学反应3Fe+4H2O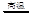 Fe3O4 +4H2,转移8e-,所以0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA,A项正确;根据MnO2 +4HCl
Fe3O4 +4H2,转移8e-,所以0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA,A项正确;根据MnO2 +4HCl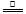 MnCl2 + Cl2 ↑+2H2O 2HCl被氧化时转移电子2e-,则0.4 molHCl被氧化时,转移电子数目为0.4 NA,B项正确;铁在浓硫酸中钝化,C项错误;5NH4NO3
MnCl2 + Cl2 ↑+2H2O 2HCl被氧化时转移电子2e-,则0.4 molHCl被氧化时,转移电子数目为0.4 NA,B项正确;铁在浓硫酸中钝化,C项错误;5NH4NO3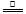 2HNO3+4N2↑+9H2O反应中,转移电子15e-,生成28gN2时,转移的电子数目为3.75NA,D项正确;选C。
2HNO3+4N2↑+9H2O反应中,转移电子15e-,生成28gN2时,转移的电子数目为3.75NA,D项正确;选C。
考点:考查阿伏伽德罗常数及计算。
本题难度:一般
2、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2 mol
B.1 mol
C.0.5 mol
D.0.25 mol
参考答案:D
本题解析:
试题分析:由题意知,锌的化合价由0价升高到+2价,生成1 mol硝酸锌,即有1 mol锌被氧化,失去2mole-,氮元素的化合价由+5价降为—3价,1 mol硝酸被还原得8 mole-,根据电子守恒,有0.25 mol硝酸被还原,选D。
考点:考查电子守恒法计算。
本题难度:一般
3、选择题 发射“嫦娥二号”的长征火箭由三个子级构成。其中一子级上部装有液体四氧化二氮(N2O4),下部装有液体偏二甲肼(C2H8N2)高能燃料。发动机内燃烧的化学方程式为:C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑,该反应中
A.C2H8N2发生还原反应
B.C2H8N2是氧化剂
C.N2O4发生氧化反应
D.N2O4是氧化剂
参考答案:D
本题解析:
试题分析:根据反应方程式可知,偏二甲肼中氮元素的化合价从-3价升高到0价,碳元素的化合价从-1价升高到+4价,因此偏二甲肼是还原剂,被氧化发生氧化反应;N2O4中氮元素的化合价从+4价降低到0价,因此N2O4是氧化剂,被还原发生还原反应,所以正确的答案选D。
本题难度:一般
4、选择题 下列叙述正确的是
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.氧化剂在同一反应中既可以是反应物,也可以是生成物
D.还原剂在反应中发生还原反应
参考答案:B
本题解析:A错误,氧化还原反应的实质是电子转移。
B正确,单质产生的分解反应,说明物质由化合态转变成游离态,要么得电子,要么失电子,所以一定是氧化还原反应。
C错误,氧化剂必须是指反应物。
D错误,还原剂在反应中发生的是氧化反应。
本题难度:简单
5、填空题 我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时会产生N2、CO2等。
(1)爆炸时的化学方程式为:?????????????????????????????。(2分)
(2)在黑火药爆炸的反应中硫作氧化剂,在一些反应中硫也可以作还原剂,写出一个硫在反应中作还原剂的化学方程式:????????????????????????。(2分)
(3)氮气在放电条件下与氧气反应的化学方程式:????????????????。(2分)
(4)一氧化氮、二氧化氮都是氮氧化物。一氧化氮在常温下很容易与空气中的氧气化合,化学方程式为:??????????。(2分)二氧化氮能与水反应,化学方程式为:?????????。(2分)
参考答案:(1)S+3C+2KNO3 本题解析:
本题解析:
试题分析:(1)木炭、硫磺、硝石在点燃的条件下生成硫化钾、氮气和二氧化碳,反应的化学方程式为S+3C+2KNO3 K2S+N2↑+3CO2↑。
K2S+N2↑+3CO2↑。
(2)还原剂失去电子,化合价升高,例如硫在氧气中燃烧生成SO2,反应的化学方程式为S+O2 本题难度:一般
本题难度:一般