微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列四组混合气体体积比为
①NO2:O2=2:1②NO:O2=2:1③NH3:O2=2:1④NO2:NO:O2=1:1:1,将分别盛满上述各种气体的容积相等的四支试管倒置于盛有水的水槽中,最后试管内液面由低到高顺序正确的是(?)
A.④③②①
B.④①②③
C.③①④②
D.③②①④
参考答案:D
本题解析:设混合气的物质的量都是1mol,则①中反应是4NO2+O2+2H2O=4HNO3,所以氧气过量,剩余氧气是1/6mol;②中反应是4NO+3O2+2H2O=4HNO3,所以NO过量,剩余NO是2/9mol;③中氨气全部溶于水,剩余氧气是1/3mol;④中反应是NO2+NO+O2+H2O=2HNO3,所以气体没有剩余的,因此试管内液面由低到高顺序③②①④,答案选D。
本题难度:简单
2、选择题 稀硫酸中插一块铜片,加入下列物质后,可使铜片发生反应的是 (? )
A.稀盐酸
B.硫酸钠晶体
C.硝酸钾晶体
D.氯化钠晶体
参考答案:C
本题解析:铜在金属活动顺序表中排在H的后面,和稀硫酸、盐酸均不反应,A不正确;硫酸钠和氯化钠与铜也不反应。但硝酸钠溶于水后,由于溶液显酸性,在酸性条件下NO3-能把铜氧化,答案选C。
点评:该题是基础性试题的考查,难度不大。明确铜的化学性质,特别是酸性条件下,硝酸盐的氧化性是答题的关键,注意相关知识的积累和总结。在离子共存中经常出现NO3-的氧化性,需要引起注意。
本题难度:一般
3、实验题 如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
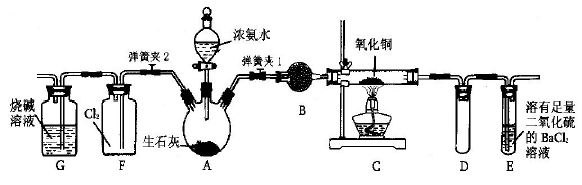
(l)写出装置A中所发生的化学反应?
(2)装置B中盛放试剂是?
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产
生?(填写反应现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式?
(4)已知Cu2O是一种红色固体物质, 在高温条件下可由CuO分解得到:4CuO=2Cu2O+O2↑,生成的Cu2O 也能被NH3还原。当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是?(用化学式表示)
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式?
参考答案:(1)NH3·H2O+CaO= Ca(OH)2 + NH3 ↑?(2)碱石灰或生石灰
(3)白色沉淀;2NH3+3CuO 3Cu+N2↑+3H2O?(4)Cu2O、Cu
3Cu+N2↑+3H2O?(4)Cu2O、Cu
(5)3Cl2+8NH3=N2+6NH4Cl
本题解析:(l)装置A为氨气的发生装置,利用浓氨水和生石灰反应生成氢氧化钙和氨气,发生的化学反应为NH3·H2O+CaO= Ca(OH)2 + NH3 ↑;(2)装置B为氨气的干燥装置,盛放试剂是碱石灰或生石灰;?(3)装置E的作用为除去过量的氨气,发生的反应为SO2+2NH3·H2O=(NH4)2SO3+H2O,
(NH4)2SO3+BaCl2 Ba SO3+ NH4Cl,装置E中的现象为:溶液里出现大量气泡,同时产生白色沉淀;根据题意知,装置C中发生的反应为氨气与氧化铜在加热条件下反应生成铜、氮气和水,化学方程式为2NH3+3CuO
Ba SO3+ NH4Cl,装置E中的现象为:溶液里出现大量气泡,同时产生白色沉淀;根据题意知,装置C中发生的反应为氨气与氧化铜在加热条件下反应生成铜、氮气和水,化学方程式为2NH3+3CuO 3Cu+N2↑+3H2O;(4)16gCuO中含有铜元素质量为16g×64/80=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,n(Cu)=0.2mol,含有氧元素的质量为13.6g-12.8g=0.8g,n(O)=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,剩余固体为Cu2O、Cu;(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,装置F中产生白烟,发生的反应为3Cl2+8NH3=N2+6NH4Cl。
3Cu+N2↑+3H2O;(4)16gCuO中含有铜元素质量为16g×64/80=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,n(Cu)=0.2mol,含有氧元素的质量为13.6g-12.8g=0.8g,n(O)=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,剩余固体为Cu2O、Cu;(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,装置F中产生白烟,发生的反应为3Cl2+8NH3=N2+6NH4Cl。
本题难度:一般
4、选择题 浓硝酸与下列物质反应时,既表现氧化性,又表现酸性的是(?)
A.Cu(OH)2
B.Cu
C.木炭
D.FeO
参考答案:BD
本题解析:浓HNO3在反应过程中得电子表现出氧化性,若有盐生成,则表现出酸性。
本题难度:简单
5、填空题 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,
其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为:?。从装置的设计看,确定E中空气已被赶尽的实验现象是:______________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 ?。有人认为E中收集到的可能是H2而不是NO,如何证明??。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是?。
(4)装置D的作用是?。
参考答案:(1)将装CaCO3的干燥管下移与稀HNO3反应产生CO2;C处出现白色沉淀
(2)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O用F向E中鼓入空气,E内气体由无色变成棕色
(3)应左导管短,右导管长有利于排尽空气?(4)吸收多余的尾气,防止污染环境
本题解析:(1)要除去装置中残留的空气,可以利用碳酸钙和硝酸反应生成的CO2来实现,即将装CaCO3的干燥管下移与稀HNO3反应产生CO2;当装置中空气被排尽后,C中的澄清石灰水会变混浊,据此可以判断E中空气已被赶尽。
(2)硝酸是氧化性酸,和铜反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。由于NO极易被氧化生成红棕色的NO2,据此可以证明。即操作是用F向E中鼓入空气,E内气体由无色变成棕色
(3)在未鼓入空气的情况下,E中就产生红棕色,这说明E中空气没有完全被排尽。由于CO2的密度大于空气的,因此正确的设计应该是左导管短,右导管长,这样才有利于排尽空气。
(4)NO、NO2等都是大气污染物,氢氧化钠溶液的主要是吸收多余的尾气,防止污染环境。
点评:该题是中等难度的试题,也是高考中的常见题型。在注重对硝酸基础知识巩固和训练的同时,侧重对学生能力的培养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般