微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
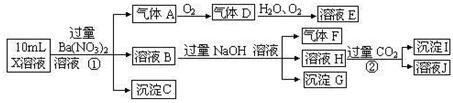
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ▲ ,不能确定是否含有的离子(M)是 ▲ ,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲ 。
▲ 。
(2)沉淀I的化学式为 ▲ ,气体F的电子式为 ▲ 。
(3)写出生成A的离子方程式: ▲ 。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式 ▲ 。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为 ▲ 。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含 ▲ 。
参考答案:(15分) (1)A13+、NH4+、Fe2+ SO42- Fe3+ Cl-
取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl- (每空各2分)
(2) Al(OH)3 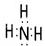 (每空各1分)
(每空各1分)
(3)3Fe2++4H++NO3-==3Fe3++NO+2H2O (2分)
(4)3ClO-+2Fe(OH)3+4OH-==3Cl-+2FeO42-+5H2O (2分)
(5)C(NH4+)> C(NO3-)> C(OH-)> C(H+) (2分)
(6)Fe3+ (1分)
本题解析:略
本题难度:一般
2、选择题 常温时某溶液由水电离出c(H+)=a mol/L,c(OH-)=b mol/L,且a·b=1×10-28,该溶液中可能大量共存的离子是
[? ]
①I-、Cl-、Ba2+、NO3- ②Na+、NO3-、K+、CO32-
③K+、SO42-、Na+、AlO2- ④HCO3-、NO3-、Al3+、SO42-
A.只有①④
B.只有②③
C.①②③
D.①②③④都不能
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列各组中的离子能大量共存的是( )
A.H+、Na+、NO3-、SiO32-
B.NH4+、K+、Cl-、OH-
C.Mg2+、NH4+、NO3-、SO42-
D.K+、H+、SO32-、ClO-
参考答案:A.因H+、SiO32-能结合生成硅酸沉淀,则不能共存,故A错误;
B.因NH4+、OH-能结合生成弱电解质,则不能共存,故B错误;
C.该组离子之间不反应,则能够共存,故C正确;
D.因H+、SO32-能结合生成水和气体,H+、ClO-能结合生成弱电解质,则不能共存,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 常温下,下列各组离子在指定的溶液中可能大量共存的是
A.无色透明溶液中:Al3+、Ca2+、Cl-、HCO3-
B.含大量Fe3+的溶液中:K+、I-、SO42-、NO3-
C.与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F-
D.由水电离出的c(H+)=1.0×10-14 mol·L-1的溶液中:Mg2+、K+、Cl-、SO42-
参考答案:D
本题解析:A项,Al3+与HCO3-相互促进水解不能大量共存;B项,Fe3+氧化I-;C项,与Al反应放H2的溶液是酸性溶液或碱性溶液,在酸性溶液中,F-不能大量存在,在碱性溶液中, NH4+不能大量存在;D项,由水电离出的c(H+)=10-14 mol·L-1的溶液呈酸性或碱性,Mg2+、K+、Cl-、SO42-在酸性条件下能大量共存。
本题难度:一般
5、选择题 下列各组离子一定能大量共存的是
A.某无色透明的酸性溶液:Cl-、Na+、MnO4-、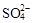
B.能使pH试纸变深蓝色的溶液:Na+、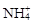 、K+、
、K+、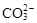
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl-
D.由水电离产生的c(H+)=10?12mol/L的溶液:K+、Ba2+、Cl-、NO3-
参考答案:D
本题解析:A、无色透明溶液里不能有MnO4-这种有色离子,错误;B、能使pH试纸变深蓝色,溶液为碱性,不能有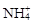 ,错误;C、NaOH溶液中的OH-与HCO3-不共存,错误;D、由水电离产生的c(H+)=10?12mol/L的溶液,可以是强酸或强碱溶液,这组离子都能共存,正确。
,错误;C、NaOH溶液中的OH-与HCO3-不共存,错误;D、由水电离产生的c(H+)=10?12mol/L的溶液,可以是强酸或强碱溶液,这组离子都能共存,正确。
本题难度:一般