微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:
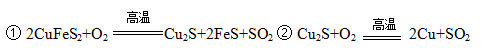
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是?。
(2)反应②中还原剂是?。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
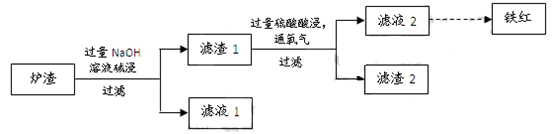
① 炉渣碱浸时反应的离子方程式是?、?。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是?;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中?。
参考答案:(1)-2
(2)Cu2S
(3)①SiO2+2OH-=SiO32-+H2O? Al2O3+2OH-=2AlO2-+H2O
②4FeO+O2+12H+=4Fe3++6H2O 再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。
本题解析:(1)二硫化亚铁铜也可以表示为CuS。FeS,其中硫元素的化合价是-2价;
(2)反应②中Cu2S中Cu元素的化合价由+1价升高到+2价,硫元素的化合价由-2价升高到+4价,被氧化,做还原剂;
(3)①炉渣中加入过量氢氧化钠溶液发生的离子方程式是SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;②滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是,4FeO+O2+12H+=4Fe3++6H2O;为检验铁元素是否被完全氧化,可难舍难分滤液中是否含有Fe2+,应进行的实验操作是,取少量滤液2于试管中,再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。
本题难度:一般
2、选择题 下列各反应,能用同一离子方程式表示的是( )
A.醋酸和氢氧化钠溶液醋酸和氨水
B.氯化钡溶液与硫酸铜溶液氢氧化钡溶液与硫酸铜溶液
C.氢氧化钡与稀硫酸氢氧化钡与稀盐酸
D.石灰石与稀硝酸石灰石与稀盐酸
参考答案:A.醋酸和氢氧化钠溶液离子方程式为CH3COOH+OH-=CH3COO-+H2O,醋酸和氨水混合反应离子方程式为CH3COOH+NH3.H2O=NH4++CH3COOH+H2O,所以二者离子方程式不同,故A错误;
B.氯化钡和硫酸铜反应生成硫酸钡沉淀和可溶性的氯化铜,离子反应方程式为Ba2++SO42-=BaSO4↓,氢氧化钡和硫酸铜反应生成氢氧化铜和硫酸钡沉淀,离子反应方程式为,Ba2++2OH-+SO42-+Cu2+=Cu(OH)2+BaSO4↓,所以二者不同,故B错误;
C.氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,离子方程式为Ba2++2OH-+SO42-+2H+=2H2O+BaSO4↓,氢氧化钡和稀盐酸反应生成氯化钡和水,离子方程式为OH-+H+=H2O,故C错误;
D.石灰石都是难溶物,稀硝酸和稀盐酸都是强酸,离子方程式都是CaCO3+2H+=Ca2++CO2↑+H2O,所以离子方程式相同,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列化学用语,正确的是(?)
A.双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+===2Mn2++4O2↑+6H2O
B.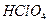 的电离方程式:
的电离方程式: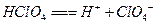
C.电解氢氧化钠溶液铁作阳极的电极方程式为: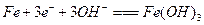
D.表示中和热的热化学方程式:2NaOH(aq)+H2SO4(aq) ===Na2SO4(aq)+2H2O(l)
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (8分)写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)___________________________________________ ___
___
(2)碳酸钠溶液与盐酸混合_________________________ ________________________
________________________
(3)硫酸铜溶液和氢氧化钡溶液混合____________________
(4)向足量澄清石灰水中通入二氧化碳_______________________________
参考答案:(8分)(1)Fe2 O3+6H+
O3+6H+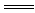 2Fe3++3H2O
2Fe3++3H2O
(2)CO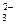 +2H+
+2H+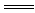 H2O十CO2↑
H2O十CO2↑
(3)Cu2++SO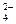 +Ba2++2OH-
+Ba2++2OH-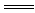 BaSO4↓+Cu(OH)2↓
BaSO4↓+Cu(OH)2↓
(4)Ca2++2OH-+CO2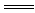 CaCO3↓+H2O(每空2分)
CaCO3↓+H2O(每空2分)
本题解析:略
本题难度:一般
5、选择题 下列化学反应的离子方程式正确的是(?)
A.在稀氨水中通入过量CO2:NH3·H2O + CO2 = NH4+ + HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ +2ClO— = CaSO3↓+2HClO
C.用稀盐酸与大理石反应:2H+ + CO32— = H2O + CO2↑
D.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2+ +OH— +H+ + SO42- = BaSO4↓+H2O
参考答案:A
本题解析:A中反应CO2过量,所以选项A正确;B中SO2具有还原性,次氯酸钙具有氧化性,二者发生反应生成硫酸钙,B不正确;大理石是难溶性物质,应该用化学式表示,C不正确;D中没有配平,应该是Ba2+ +2OH— +2H+ + SO42- = BaSO4↓+2H2O,D不正确,答案选A。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般