| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》答题技巧(2017年最新版)(八)
参考答案:A 本题解析:NaHSO3溶液呈酸性,表明HSO3-的电离程度大于水解程度,但是电离和水解都比较微弱,所以A对;B项结合物料守恒,应该为c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3);C项应为c(Na+)>c(HSO3-) > c(H+) > c(OH-);结合电荷守恒可知D项错误,应为c(Na+) + c(H+) = c(HSO3-) + c(OH-) +2 c(SO32-). 本题难度:一般 2、填空题 (14分)I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。 ②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母): a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆 c.容器内压强保持不变 d.混合气体的密度保持不变 ③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。 II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。 A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 (2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。 参考答案:Ⅰ(1)NO2(g) + CO(g) = CO2(g) + NO(g) △H=—234kJ·mol-1(2分) 本题解析:Ⅰ、(1)根据图像可知反应物的总能量高于生成物的总能量,因此反应热△H=—368kJ/mol+134kJ/mol=—234kJ/mol,则该反应的热化学方程式为 NO2(g) + CO(g)=CO2(g) + NO(g) △H=—234kJ·mol-1。 本题难度:一般 3、选择题 在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O |
参考答案:B
本题解析:水解平衡常数只与温度有关,A错;通入CO2,OH-浓度会减小,平衡向正反应方向移动,B对;
升高温度平衡向正向移动,c(HCO3-)增大,c(CO32-)减小,故c(HCO3-)/c(CO32-)增大,C错; NaOH是强碱,加入NaOH固体,溶液的碱性增强,pH增大,D错。
考点:水解平衡的移动和溶液中离子浓度大小变化
本题难度:一般
4、选择题 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图,下列判断正确的是( )
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
D.a、b、c三点溶液水的电离程度a>b>c
参考答案:D
本题解析:pH=4的HCl溶液和NH4Cl溶液,在稀释过程中,因平衡NH4++H2O NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
本题难度:一般
5、填空题 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
参考答案:(1)1:2
(2)Zn(OH)2+2OH-=ZnO22-+2H2O
(3)Cl-、NO3-
(4)C
(5)将pH试纸放在玻璃片上,用玻璃棒醮取待测点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数
(6)Fe3+(aq) +3H2O(l)  Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 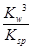
本题解析:(1)4Zn+10HNO3 4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
(2)偏铝酸钠在水溶液中都是以Na[Al(OH)4]的形式存在,以前只不过是为了方便,把它简写成NaAlO2。但它的实际组成还是Na[Al(OH)4]。 NaAlO2偏铝酸钠是简写,就像氢离子(H+)实际上是水合氢离子一样。[Zn(OH)4]-与此相类似。
(4)在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫作沉淀溶解平衡。这时,离子浓度的乘积为一常数,叫作溶度积,用Ksp表示。很明显,滤液E的pH=4时,Zn(OH)2已经溶解,所以无法求得溶度积,而Fe(OH)3是已沉淀形式存在,所以可以求得。
(6)由②×3-①即可得到Fe3+(aq) +3H2O(l)  Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) KW=c(OH-)·c(H+)
Fe3+发生水解反应的平衡常数:K=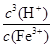 =
=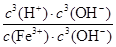 =
=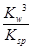
考点:考查化学综合运用。
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学试题《分子式、结构式、.. | ||