微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某化学研究小组同学认为NH3中N元素处于最低价,得出NH3应具有还原性的结论,并设计了如下实验装置进行研究(夹持装置未画出)

请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式______.
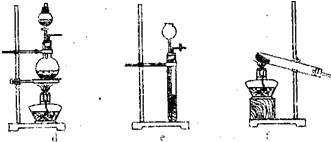
(2)该实验中的A部分的装置是下图中的______(填写装置的序号).
(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明"Cu0能被NH3还原,该反摩的化学方程式是______.
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施______.
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.
参考答案:(1)实验室中利用氯化铵和强碱氢氧化钙反应来获得氨气,即2NH4Cl+Ca(OH)4?△?.?CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)4?△?.?CaCl2+2NH3↑+2H2O;
(2)根据实验目的,装置A为获得氨气的部分,可以用固体和液体加热的装置来获得氨气,故答案为:f;
(3)氧化铜能和还原性的氨气发生反应,生成金属铜和氮气、水,即3CuO+2NH3?△?.?3Cu+N2+3H2O,
故答案为:3CuO+2NH3?△?.?3Cu+N2+3H2O;
(4)无水硫酸铜变蓝可以检验水的生成,为了检验水是氨气和氧化铜反应的产物,一定要防止外界水的干扰,实验室制得的氨气中含有水,可以用碱石灰干燥,空气中的水也要防止进入C中,同时多余的氨气具有毒性,必须进行尾气处理,可以再C后面再接一个装有浓硫酸的洗气瓶,
故答案为:在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验;
(5)金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应,可以在试管中加入少量反应后的固体,然后滴加稀硫酸,震荡后观察,若溶液变蓝,则说明反应后的固体中含有氧化亚铜,如果无明显变化,则说明反应后的固体中不含有氧化亚铜.
故答案为:在试管中加入少量反应后的固体,然后滴加稀硫酸,震荡后观察,若溶液变蓝,则说明反应后的固体中含有氧化亚铜,如果无明显变化,则说明反应后的固体中不含有氧化亚铜.
本题解析:
本题难度:一般
2、简答题 化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀.为此,小组同学对沉淀成份作了如下探究:
I.探究蓝色沉淀的成份
[猜想]:蓝色沉淀①可能是CuCO3;②可能是Cu(OH)2;③是两者的混合物.
[设计方案]:小组同学利用下列装置通过实验测定其组成

[问题与讨论]
(1)写出②猜想的依据______.
(2)装置A中碱石灰的作用是______.
(3)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是______.
(4)若沉淀样品的质量为mg.装置C质量增加了ng,则沉淀中CuCO2的质量分数为______.
II.通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜(化学式为CUSO4?3Cu(OH)2).请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法______.
参考答案:I.(1)CO32-水解成碱性,溶液中存在较多的氢氧根离子,而Cu2-与OH-结合生成沉淀Cu(OH)2,
故答案为:CO32-水解成碱性,Cu2+与OH-结合生成Cu(OH)2;
(2)该实验原理是通过验证并测定水以及二氧化碳的存在、质量来确定沉淀的组成情况,为了防止空气中水以及二氧化碳的干扰,要用碱石灰来吸收空气中的H2蒸汽和CO2,故答案为:吸收空气中的H2蒸汽和CO2;
(3)该实验原理是通过验证并测定水以及二氧化碳的存在、质量来确定沉淀的组成情况,为了防止装置中的空气对实验结果的影响,必须在点燃酒精灯之前通过量的空气,排除空气,并称量C、D的质量,
故答案为:通过量的空气并称量C、D的质量;?
(4)装置C质量增加了ng,则生成水的质量是ng,根据氢氧化铜的分解方程式:Cu(OH)2?△?.?CuO+H2O,当生成ng的水时,则含有氢氧化铜的质量是49n9g,则沉淀中CuCO3的质量为:m-49n9g,所以沉淀中CuCO3的质量分数为:m-49n9m×100%=1-49n9m,故答案为:1-49n9m;
II.硫酸根的特征离子反应:可以和钡离子反应生成硫酸钡沉淀,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子时可以先将沉淀洗涤干净,在加入足量稀盐酸溶解浅绿色沉淀,再用BaCl2溶液检验,故答案为:将浊液过滤,并把沉淀用蒸馏水洗涤至洗涤液用BaCl2溶液检验不出SO42-后,加入足量稀盐酸溶解浅绿色沉淀,再用BaCl2溶液检验,若溶液中有大量白色沉淀生成,则浅绿色没淀中有SO42-.
本题解析:
本题难度:一般
3、选择题 下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向Ca(ClO)2溶液中通入过量CO2?②向AlCl3溶液中逐滴加入过量氨水
③向CuSO4溶液中逐滴加入过量氨水?④向Na2SiO3溶液中逐滴加入过量的盐酸.
A.只有③
B.只有①③
C.只有①②③
D.①②③④
参考答案:B
本题解析:
本题难度:一般
4、简答题 三星堆遗址考古的重大发现,揭开了川西平原早期蜀国的面纱,将蜀国的历史推前了两千多年,填补了中国考古学、青铜文化、青铜艺术史上的诸多空白.而硫酸铜是湿法冶金应用极早的一种化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
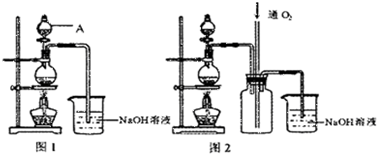
(1)图1烧瓶中发生反应的离子方程式为______;
(2)图2是图1的改进装置,其优点有______;
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在①坩埚中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用.[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为:3.7、6.4.]请回答下列问题:
①方案2中甲物质是______(填字母序号).?a.CaO? b.CuCO3? c.CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL?1.5mol?L-1的稀硫酸中,控温在50℃.加入18mL?10%的H2O2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得到CuSO4?5H2O的质量为10.6g.?
?请回答下列问题:
②加热时温度不宜过高的原因是______,根据有关数据计算出制取CuSO4?5H2O的产率(实际产量与理论产量的百分比)=______.
参考答案:(1)将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,铜粉与稀硫酸不反应,铜与浓硝酸反应,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,随着反应的进行,浓硝酸变成稀硝酸,稀硝酸和铜反应生成硝酸铜和一氧化氮、水,3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)改进前,二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮有毒且和水不反应,所以NO、NO2有毒气体不能被完全吸收,且二氧化氮和氢氧化钠反应后,导管内压强减小,易产生倒吸现象;改进后,通入氧气,氧气、一氧化氮、二氧化氮、水反应完全生成硝酸被氢氧化钠吸收;且中间储气瓶有缓冲作用,防止倒吸.
故答案为:可防止倒吸;NO、NO2有毒气体能被完全吸收;
(3)①除杂的原则,保证不引入杂质,加入氧化钙或碳酸钙都能引进新的杂质,故ac错误,故答案为:b;
?②过氧化氢不稳定,温度过高易分解生成水和氧气;设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4?5H2O?
64g? 250g
3.2g? xg
所以x=12.5
理论上生成CuSO4?5H2O?12.5克,故产率为10.6g12.5g×100%=84.8%,
故答案为:防止双氧水分解;84.8%.
本题解析:
本题难度:一般
5、选择题 在25℃时,有80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末a?g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
A.溶液中c(Ba2+)将增大
B.溶液的pH将增大
C.溶液中Ba2+的物质的量将减少
D.溶液中c(OH-)减少
参考答案:C
本题解析:分析:80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末a?g,BaO粉末与水反应生成Ba(OH)2,消耗水,溶液有Ba(OH)2析出,恢复至原温度25℃,溶液浓度不变,仍为饱和溶液,据此即可解答.
解答:A.BaO和水发生:BaO+H2O=Ba(OH)2消耗水,饱和的Ba(OH)2溶液中有Ba(OH)2析出,溶液中Ba2+数目减少,但反应后仍为饱和溶液,溶液的pH不变,溶液中c(Ba2+)不变,故A错误;
B.BaO和水发生,恢复至原温度,析出Ba(OH)2,仍为饱和溶液,溶液浓度不变,溶液的pH不变,故B错误;
C.BaO和水发生,消耗水,有Ba(OH)2析出,溶液中Ba2+数目减少,故C正确;
D.BaO和水发生,恢复至原温度,析出Ba(OH)2,仍为饱和溶液,溶液浓度不变,溶液中c(OH-)不变,故D错误;
故选C.
点评:本题考查BaO与水的反应,以及饱和溶液的性质,注意饱和溶液的性质,当溶剂减小,溶液中要析出晶体,但溶液的浓度不变.题目难度不大.
本题难度:一般