微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,将铁片放入下列溶液中,能明显观察到有气体产生的是:(?)
A.浓硫酸
B.稀硫酸
C.ZnSO4溶液
D.CuSO4溶液
参考答案:B
本题解析:略
本题难度:简单
2、简答题 I.硫酸铁糖衣药片是一种治疗缺铁性贫血的药剂.某化学课外活动小组测定其中铁元素含量的实验步骤如下:

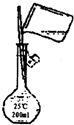
(1)刮除药片糖衣称得样品ag,将其研碎后迅速溶解,配制溶液.操作如图所示,操作是否正确,______,如不正确,说明原因(正确可不填写)
(2)洗涤的目的是除去附着在沉淀上的______.(写离子符号)
(3)将沉淀物灼烧,冷却至室温,称得其质量为b1g,再次灼烧并冷却至室温称得其质量为b2?g,若b1-b2=0.3,则接下来的操作______,后通过计算可得出结果.
(4)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是______
(用化学方程式表示)
II.某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失.大家经查阅资料后发现,可能的原因是发生了下列反应:AgI+I-

[AgI2]-
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验.
实验l:向浓Ⅺ溶液中滴加AgNO3溶液,观察到无沉淀生成.
实验2:向AgNO3溶液中滴加Ⅺ溶液,有黄色沉淀生成;再______.
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀.请解释出现沉淀的原因______.
(3)丙同学在实验所得的溶液中,滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色.大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是______.
同学们通过查阅资料知道,AgCl沉淀能溶于浓氨水.请写出这一反应的离子方程式______.
参考答案:I.(1)容量瓶是专门配制精确一定物质的量的浓度的溶液的仪器,本实验中须250.00mL溶液,精确到0.01mL,所以必须用250mL容量瓶,图中是200mL容量瓶错误,
故答案为:不正确;容量瓶应该是250mL;
(2)根据测定其中铁元素含量的实验步骤知,加入稀硫酸引入硫酸根离子,加入氯水引入氯离子,加入氨水引入氨根离子和氢氧根离子,灼烧红棕色的固体,目的是得到三氧化二铁,否则灼烧前的固体中混有硫酸铁等杂质,须除去这些杂质,
故答案为:NH4+、Cl-、SO42-、OH-、;
(3)将沉淀物灼烧的目的是得到恒重的三氧化二铁固体,如果不恒重,说明固体中含有结晶水影响铁的含量的测定,所以固体须恒重,因实验室测固体用的是托盘天平,托盘天平的精确度为0.1克,所以将沉淀物灼烧,冷却至室温,称得其质量为b1g,再次灼烧并冷却至室温称得其质量为b2?g,若b1-b2=0.3,则接下来的操作是再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1克为止,
故答案为:再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1克为止;
(4)氢氧化亚铁中+2价的铁具有还原性,空气中的氧气具有还原性,氢氧化亚铁在空气中很快被氧气氧化,发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,只有氢氧化铁,效果与加入氯水后最终的效果相同,
答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
II.(1)甲同学设计了两个简单的实验方案来进行验证,AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失,实验操作中已经得到了黄色沉淀,根据可能发生的反应AgI+I-?[AgI2]-,知再继续滴加KI溶液,黄色沉淀溶解,
故答案为:继续滴加KI溶液,黄色沉淀溶解;
(2)乙同学在实验所得的溶液中滴加硝酸溶液,硝酸具有强氧化性,能将碘离子氧化成单质碘,使碘离子的浓度降低,对于AgI+I-?[AgI2]-,反应物浓度降低,平衡向逆反应方向移动,所以出现碘化银黄色沉淀,
故答案为:加入硝酸溶液后,硝酸将碘离子氧化,使碘离子浓度减小,平衡AgI+I-?[AgI2]-逆向移动;
(3)丙同学在实验所得的溶液中,滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色,可通过查阅它们的溶解度比较大小,溶解度小的易形成沉淀,所以所查阅的数据是AgI、AgCl的溶解度;AgCl沉淀能溶于浓氨水.形成了络合物[Ag(NH3)2]+,
故答案为:AgI、AgCl的溶解度;AgCl+2NH3?H2O=[Ag(NH3)2]++Cl-+2H2O;
本题解析:
本题难度:一般
3、选择题 常温下,不能用铁制容器存放的物质是
A.浓硫酸
B.浓硝酸
C.CuSO4溶液
D.稀氨水
参考答案:C
本题解析:浓硫酸、浓硝酸都可以使铁制容器发生钝化能用铁制容器存放,A、B不选;
CuSO4+Fe=" Fe" SO4+ Cu?,CuSO4溶液不能用铁制容器存放,稀氨水不与铁反应可用铁制容器存放。答案选C.
本题难度:简单
4、实验题 (12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体与Fe3+反应的主要产物是__?__?。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是?。
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与热浓H2SO4