微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。

(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
2、选择题 下列性质中,可以证明某化合物一定存在离子键的是
[? ]
A.晶体可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
3、选择题 下列化学用语表示正确的是( )
A.氯化钠的电子式
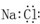
B.NaHCO3的电离方程式NaHCO3=Na++H++CO32-
C.乙醛的结构简式为CH3COH
D.氮气的结构式为N≡N
4、填空题 已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出12种元素的X的数值:
元素
| Al
| B
| Be
| C
| Cl
| F
| Li
|
X的数值
| 1.5
| 2.0
| 1.5
| 2.5
| 2.8
| 4.0
| 1.0
|
元素
| Mg
| Na
| O
| P
| S
| Si
| N
|
X的数值
| ?
| 0.9
| 3.5
| 2.1
| 2.5
| 1.7
| ?
|
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系______________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机物结构简式为: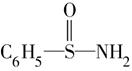 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
(5) 预测元素周期表中,X值最小的元素位置________(放射性元素除外)。
5、判断题 判断下列用电子式表示的化合物的形成过程,正确的在后面括号中填“√”,错误的在后面括号中填“×
”。
(1) ? (? ? )
? (? ? )
(2) ?(? )
?(? )
(3)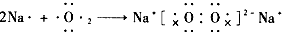 ? (? )
? (? )