微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯化氢和氧气在一定条件下反应可得到氯气,现将氯化氢和氧气混合于一密闭容器中,在一定条件下使之反应,温度高于100℃,经过5min而达到平衡,经过测定物质的浓度分别为:c(HCl)=0.25mol/L,c(O2)=0.2mol/L,c(Cl2)=0.1mol/L.则:
(1)写出反应的方程式______;
(2)开始时c(HCl)=______,c(O2)=______;
(3)从反应开始到反应平衡时,v(HCl)=______,以HCl、O2、Cl2分别表示的反应速率的数值之比为______;
(4)反应后压强是反应前的______倍.
参考答案:(1)由题意可知,HCl与氧气反应生成氯气,根据元素守恒可知还生成水,反应方程式为:4HCl+O2?2Cl2+2H2O,
故答案为:4HCl+O2?2Cl2+2H2O;
(2)平衡时,c(HCl)=0.25mol/L,c(O2)=0.2mol/L,c(Cl2)=0.1mol/L,根据4HCl+O2?2Cl2+2H2O,可知△c(HCl)=2△c(Cl2)=2×0.1mol/L=0.2mol/L,△c(O2)=12△c(Cl2)=12×0.1mol/L=0.05mol/L,故HCl的起始浓度=0.25mol/L+0.2mol/L=0.45mol/L,O2的起始浓度=0.2mol/L+0.05mol/L=0.25mol/L,
故答案为:0.45mol/L;0.25mol/L;
(3)从反应开始到反应平衡时,v(HCl)=0.2mol/L5min=0.04mol/(L.min);
不同物质表示的速率之比等于其化学计量数之比,故HCl、O2、Cl2分别表示的反应速率的数值之比为4:1:2,
故答案为:0.04mol/(L.min);4:1:2;
(4)根据4HCl+O2?2Cl2+2H2O,可知△c(H2O)=△c(Cl2)=0.1mol/L,反应后混合气体总浓度为0.25mol/L+0.2mol/L+0.1mol/L+0.1mol/L=0.65mol/L,反应前,氯化氢与氧气总浓度为0.45mol/L+0.25mol/L=0.7mol/L,故反应后压强是反应前的0.65mol/L0.7mol/L=1314倍,
故答案为:1314.
本题解析:
本题难度:一般
2、选择题 下列方法中可以说明2HI(g)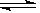 H2(g)+I2(g)已达到平衡的是(? )
H2(g)+I2(g)已达到平衡的是(? )
①单位时间内生成n mol H2的同时生成n mol HI?
②一个H—H键断裂的同时有两个H—I键断裂?
③百分组成w(HI)=w(I2)?④反应速率v(H2)=v(I2)=1/2v(HI)时?
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1时?⑥温度和体积一定时,容器内压强不再变化?
⑦温度和体积一定时,某一生成物浓度不再变化?
⑧条件一定,混合气体的平均相对分子质量不再变化?
⑨温度和体积一定时,混合气体的颜色不再变化?
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤
B.①④⑦
C.②⑦⑨
D.⑧⑨⑩
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以⑦正确。颜色的深浅和浓度有关系,所以选项⑨可以说明。反应前后气体的体积不变,因此气体的总物质的量、体积和压强始终是不变的,⑥不能说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,③⑤不能说明。①反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确。②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。速率之比是相应的化学计量数之比,因此④中的关系始终是成立,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,⑩不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,同样在反应过程中质量和物质的量始终是不变的,⑧不能说明,因此答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:简单
3、选择题 对在密闭容器中进行的可逆反应:4NH3(g)+5O2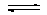 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=1∶1
B.反应达到平衡后,再向体系中充入O2,将提高NH3的转化率
C.反应达到平衡时,若向体系中充入稀有气体,速率增大
D.当v正(NH3):v正(NO)=1∶1时,说明该化学反应已经达到平衡
参考答案:B
本题解析:A 错误,起始投入的n(NH3)∶n(O2)=4∶5
B 正确,增加一种反应物的用量,会提高另一种反应物的转化率
C 错误,向体系中充入稀有气体,速率不变,因为与反应有关的物质的浓度没有变化
D 错误,当v正(NH3):v逆(NO)=1∶1时,说明该化学反应已经达到平衡
本题难度:一般
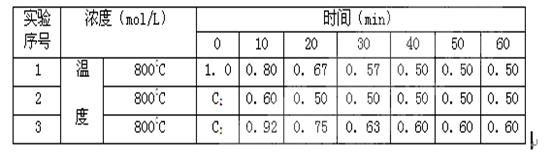
4、填空题 (9分)有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
 ?
?
(1)在实验1,反应在0至20分钟时间内A的平均速率为?mol/(L·min)。
(2)在实验2,A的初始浓度C2=?mol/L,可推测实验2中隐含的条件是?。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3?v1(填>、=、<=,)800℃时,反应平衡常数=?,且C3=?mol/L,可推测实验3中隐含的条件是?。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为?mol/L, B的转化率=?。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为?mol/L, B的转化率=?。
参考答案:

本题解析:略
本题难度:一般
5、选择题 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。若利用飞机释放的NO和CO作为反应原料,在温度一定体积为10L的容器中反应,下列说法正确的是?
2CO2+N2。若利用飞机释放的NO和CO作为反应原料,在温度一定体积为10L的容器中反应,下列说法正确的是?
A.若达平衡后充入稀有气体,体系压强增大,平衡将正向移动
B.若升高温度可减少平衡体系中NO的浓度,则该反应△H > 0
C.当体系中CO2和CO的浓度相等时,该反应达到平衡状态
D.可以探索开发更加合适的催化剂,以提高尾气的转化率
参考答案:B
本题解析:
A.容器为定容,平衡后充入稀有气体,各物质浓度并不改变,虽然体系压强增大,但平衡不会发生移动
B.升高温度,NO浓度减少,说明平衡正向移动,即正反就为吸热反应,则△H > 0
C.体系中CO2和CO的浓度相等与反应达到平衡状态无必然联系
D.催化剂只能改变反应速率,并不能使平衡移动,不会改变物质的转化率
故正确的说法为B
本题难度:一般