微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某溶液甲中可能含有下列离子中的几种:K+、NO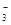 、SO
、SO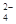 、NH
、NH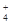 、CO
、CO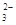 (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为672mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
(1)甲溶液中一定存在的离子是?;
(2)甲溶液中一定不存在的离子是?;
(3)甲溶液中可能存在的离子是?;你得出此结论的理由是?。
参考答案:(1)NO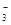 、SO
、SO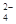 、NH
、NH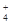 ?(2)CO
?(2)CO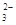
(3)K+?由题意知:溶液中含NH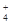 0.03mol,SO
0.03mol,SO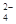 0.01mol,据电中性原理,必有NO
0.01mol,据电中性原理,必有NO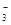 ,若NO
,若NO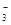 ?为0.01mol,则无K+,若NO
?为0.01mol,则无K+,若NO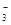 大于0.01mol,则有K+。
大于0.01mol,则有K+。
本题解析:(1)根据实验1:第一份加入足量的烧碱并加热,因NH4++OH-=NH3↑+H2O,会产生标准状况下为224mL气体,证明含有NH4+,且物质的量为0.01mol;
实验2:第二份先加入足量的盐酸,无现象,则一定不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明一定含有SO42-,且物质的量为:n="m/M" ="2.33g/233g/mol" =0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,且钾离子的浓度≥0.01mol×2?0.01mol× 0.1L ═0.1mol/L,所以该溶液中肯定含有NH4+、S042-、K+,
故答案为:K+、NH4+、S042-;
(2)实验2:第二份先加入足量的盐酸,无现象,则不含有CO32-,如果有CO32-,CO32-+2H+=H2O+CO2↑,会有二氧化碳气体产生,故答案为:CO32-;
(3)根据(1)知:钾离子的浓度≥0.01mol×2?0.01mol ×0.1L =0.1mol/L,如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-,
故答案为:NO3-;由题意知,NH4+物质的量为0.01mol,SO42-物质的量为0.01mol,根据溶液呈电中性原理,应该含有K+,如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-.
本题难度:一般
2、选择题 &nbs p;下列解释实验现象的反应方程式不正确的是
A.金属Al放入NaOH?溶液中产生大量气泡:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将盛有二氧化氮气体的试管倒立在水中,气体变为无色,有液体进入试管:3NO2+H2O=2HNO3+NO
C.淀粉KI溶液与H2SO4酸化的H2O2溶液混合,溶液变蓝:2I-+H2O2+2H+=2H2O+I2
D.溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
参考答案:D
本题解析:分析:A、金属铝和强碱溶液反应生成偏铝酸盐和氢气;
B、二氧化氮和水反应生成硝酸和无色气体一氧化氮;
C、双氧水具有氧化性,能够将碘离子氧化成碘单质;
D、由于溶液中铝离子和氢氧根离子的物质的量之比是1:4,生成了偏铝酸根离子,没有氢氧化铝沉淀生成.
解答:A、铝和氢氧化钠溶液反应的化学方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,故A错误;
B、二氧化氮和水反应的化学方程式是:3NO2+H2O=2HNO3+NO,故B错误;
C、双氧水能够氧化碘离子,反应的化学方程式是:2I-+H2O2+2H+=2H2O+I2,故C错误;
D、溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,溶液中铝离子和氢氧根离子的物质的量是1:4,生成了偏铝酸根离子,正确离子方程式是:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-↓+2H2O,故D正确;
故选D.
点评:本题考查了化学方程式的书写,注意D项铝离子和氢氧根离子的物质的量的关系,本题难度不大.
本题难度:困难
3、选择题 下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是
A.Na2CO3+HNO3与NaHCO3+HNO3
B.CaCl2+Na2CO3与Ca(NO3)2+K2CO3
C.Ba(OH)2+NaHSO4与BaCl2+NaHSO4
D.NaOH+H2SO4与Fe(OH)3+H2SO4
参考答案:B
本题解析:A项中碳酸氢根离子不能拆开;C中氢氧化钡与硫酸氢钠的反应中还有氢离子与氢氧根离子的反应;D中氢氧化铁不能拆开.
本题难度:一般
4、选择题 下列各组离子,可能大量共存于无色溶液中的是
A.Na+、H+、CO32-、NO3-
B.Fe2+、Mg2+、Cu2+、Cl-
C.Ba2+、Cl-、NO3-、OH-
D.Mg2+、OH-、HCO3-、Cl-
参考答案:C
本题解析:试题分析:A.Na+、H+、CO32-、NO3- 中H+、CO32-不共存;
B.Fe2+、Mg2+、Cu2+、Cl- 中铜离子有颜色;? D.Mg2+、OH-、HCO3-、Cl-?中Mg2+、OH-不共存,故选C。
考点:离子共存
点评:离子共存的规律是:观颜色,查酸碱,能反应(复分解反应和氧化还原反应等),不共存。
本题难度:简单
5、填空题 有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)
现将溶液两两混合,记录现象如下:
A+B→白色沉淀?;B+?D→白色沉淀;C+D→蓝色沉淀
则A、B、C、D的化学式分别是_________、__________、___________、_________。
参考答案:AgNO3 ;MgCl2 ;CuSO4 ;NaOH
本题解析:
本题难度:一般