微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃、101kPa下,碳、氢气和甲烷的燃烧热依次是393.5 kJ·mol—1、285.8 kJ·mol—1
和890.3kJ·mol—1,下列选项中正确的是
A.2H2(g)+O2(g)=2H2O(l)△H=—285.8kJ·mol—1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ·mol—1
C.H2(g)+1/2O2(g)=H2O(g)△H<—285.8kJ·mol—1
D.C(s)+2H2(g)=CH4(g)△H=—74.8 kJ·mol—1
参考答案:D
本题解析:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:①C(S)+O2(g)═CO2(g)△H=-393.5kJ·mol-1;②H2(g)+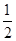 O2(g)═H2O(l)△H=-285.8kJ·mol-1;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ·mol-1,根据盖斯定律解答,2H2(g)+O2(g)=2H2O(l)?△H=—571.6kJ·mol—1,A选项错误;甲烷燃烧是放热,应该是△H=-890.3kJ·mol—1,B选项错误;液态水变为气态水,要吸收一部分热量,所以△H>—285.8kJ·mol—1;C选项错误;根据盖斯定律③-(①+②×2)得CH4(g)=C(S)+2H2(g),故△H=(-890.3KJ·mol-1)-[(-393.5KJ·mol-1)+(-285.8kJ·mol-1)×2]=+74.8KJ·mol-1,D选项正确。
O2(g)═H2O(l)△H=-285.8kJ·mol-1;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ·mol-1,根据盖斯定律解答,2H2(g)+O2(g)=2H2O(l)?△H=—571.6kJ·mol—1,A选项错误;甲烷燃烧是放热,应该是△H=-890.3kJ·mol—1,B选项错误;液态水变为气态水,要吸收一部分热量,所以△H>—285.8kJ·mol—1;C选项错误;根据盖斯定律③-(①+②×2)得CH4(g)=C(S)+2H2(g),故△H=(-890.3KJ·mol-1)-[(-393.5KJ·mol-1)+(-285.8kJ·mol-1)×2]=+74.8KJ·mol-1,D选项正确。
本题难度:一般
2、选择题 下列溶液一定呈中性的是(?)
A.c(OH-) = 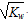 的溶液
的溶液
B.pH=7 的溶液
C.c(H+) =10-14的溶液
D.加甲基橙呈黄色的溶液
参考答案:A
本题解析:A、kw=c(H+)c(OH-), c(OH-) = 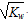 ,故溶液为中性;
,故溶液为中性;
B、如果不在25℃,该溶液不为中性,
C、该溶液可能为碱性;
D、甲基橙的变色范围为3.1~4.4,大于4.4为黄色。
本题难度:简单
3、选择题 下图为对15 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,根据图像推出X (mol/L)和Y (mol/L)的物质的量浓度是下表内各组中的

选项
| A
| B
| C
| D
|
c(X)/mol·L-1
| 0.035
| 0.070
| 0.03
| 0.06
|
c(Y)/mol·L-1
| 0.070
| 0.035
| 0.06
| 0.03
参考答案:B
本题解析:滴定过程中pH增大,所以是用氢氧化钠滴定盐酸。恰好中和时0.030×Y=0.015×X,当加氢氧化钠溶液20mL时,pH为2,此时盐酸过量,所以0.015X-0.02Y=0.035×0.01,解得Y=0.035、X=0.07。
点评:从图象中寻找有用信息。
本题难度:简单
4、选择题 下列说法不正确的是( )
A.由2H2(g)+O2(g)=2H2O(l)△H=-571.6?kJ/mol?可知氢气的燃烧热△H=-285.8?kJ/mol
B.某离子被沉淀完全是指该离子在溶液中的浓度为0
C.电解精炼铜时以粗铜作阳极
D.对于一个给定的可逆反应,平衡常数只与温度有关,与浓度、压强无关
参考答案:A、由2H2(g)+O2(g)=2H2O(l)△H=-571.6?kJ/mol,可知1mol氢气完全燃烧生成稳定的氧化物放出的热量为285.8KJ,所以氢气的燃烧热△H=-285.8?kJ/mol,故A正确;
B、某离子被沉淀完全是指该离子浓度小于10-5mol/L,故B错误;
C、电解精炼铜时以粗铜作阳极,精铜做阴极,故C正确;
D、对于一个给定的可逆反应,平衡常数只与温度有关,和外界因素中的压强、浓度等无关,故D正确.
故选B.
本题解析:
本题难度:简单
5、选择题 下列热化学方程式错误的是(注:△H的绝对值均正确)
[? ]
A.C2H5OH(l)+3O2(g)= 2CO2(g) +3H2O(g);△H= +1367.0 kJ/mol(燃烧热)
B.NaOH (a q) + HCl (aq) = NaCl(aq) +H2O (l); △H= -57.3kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H= -269.8kJ/mol(反应热)
D.2NO2=O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:AD
本题解析:
本题难度:简单
|