微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①与②中c(H+)相同
B.①与④混合,所得混合液的PH等于7
C.②和③混合,所得混合溶液的pH大于7
D.③与④分别用等浓度的盐酸中和,消耗盐酸的体积相等
参考答案:AC
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是(?)
A.pH=2和pH=l的硝酸中c(H+)之比为10:1
B.一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-)
C.KAl(SO4)2溶液中离子浓度的大小顺序为c(SO2-4)>c(K+)>c(Al3+)>c(H+)>c(OH-)
D.常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大
参考答案:C
本题解析:A:pH=2和pH=l的硝酸中c(H+)之比为1:10,排除
B:酸碱中和后溶液不一定呈中性,c(H+)与c(OH-)不一定相等,不正确
C:由于铝离子部分水解,溶液呈酸性,正确
D:由于弱碱存在电离平衡,在稀释过程中可以促进其电离,故稀释相同倍数后,氨水的pH较大,不正确
答案为C
本题难度:简单
3、计算题 在25℃时取pH=x(x≤6)的盐酸溶液,VxL和pH=y(y≥8)的氢氧化钠溶液VyL,恰好中和。
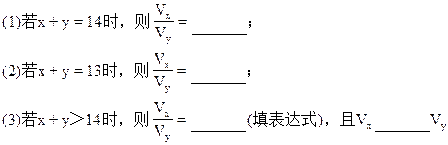
(填>、<、=)。
参考答案:

本题解析:根据强酸溶液[H+]与强碱溶液[OH-]浓度关系与强酸溶液的pH酸与强碱溶液的pH碱之和之间存在如下规律:
当pH酸+pH碱=14时,则该强酸溶液的[H+]浓度跟强酸溶液的[OH-]浓度相等。
当pH酸+pH碱>14时,则该强碱溶液的[OH-]浓度大于强酸溶液的[H+]浓度,如当pH酸+pH碱=15,则强碱溶液的[OH-]浓度比强酸溶液的[H+]浓度大10倍。
当pH酸+pH碱<14时,则该强酸溶液的[H+]浓度大于强碱溶液的[OH-]浓度,如pH酸+pH碱=13,则强酸溶液[H+]浓度比强碱溶液的[OH-]大10倍。
可见若x+y=14,即盐酸的[H+]与氢氧化钠溶液的[OH-]浓度相等,完
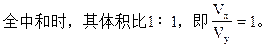
若x+y=13,即盐酸的[H+]的浓度比氢氧化钠溶液中[OH-]浓度大10
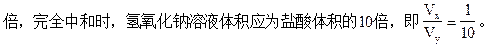
若x+y>14,氢氧化钠溶液的[OH-]浓度大于盐酸中[H+]的浓度,∴Vx>Vy。

盐酸中pH=x,[H+]=10-x
恰好完全中和时,10-x×Vx=10y-14×Vy

本题难度:一般
4、填空题 某温度(t℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
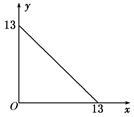
(1)此温度下,水的离子积KW为________,则该温度t__________25℃(填“>”“<”或“=”),pH=7的溶液显________(填“酸”“碱”或“中”)性。
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计)。试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=______________________________________;
②若所得混合液的pH=2,则a∶b=____________________________________。
参考答案:(1)1×10-13 > 碱 (2)①10∶1 ②9∶2
本题解析:(1)由图知KW=1×10-13>10-14,则t>25℃,中性时pH=6.5,当pH=7时溶液呈碱性;(2)pH=11的NaOH溶液中[OH-]=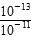 =10-2mol·L-1,溶液呈中性时,n(H+)=n(OH-)即10-1×b=10-2×a,a∶b=10∶1;若混合液pH=2,则
=10-2mol·L-1,溶液呈中性时,n(H+)=n(OH-)即10-1×b=10-2×a,a∶b=10∶1;若混合液pH=2,则 =10-2,得a∶b=9∶2。
=10-2,得a∶b=9∶2。
本题难度:一般
5、选择题 已知在100℃的温度下(本题涉及的溶液其温度均为100℃,水的离子积KW=1.0×10-12 mol2·L-2。下列说法中正确的是
A.0.05 mol·L-1的H2SO4溶液,pH=1
B.0.001 mol·L-1的NaOH溶液,pH=11
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
参考答案:A
本题解析:A:c(H+)=0.1mol/L,pH=—lg c(H+)=1
B:c(OH—)=0.001mol/L,c(H+)=1.0×10-9mol/L,pH=—lg c(H+)=9
C:两者恰好中和,混合溶液的pH=6,溶液呈中性。
D:酸提供的n(H+)=1.0×10-3×0.05,碱提供的n(OH—)=1.0×10-1×V,可得V="0.5" mL
本题难度:一般