微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)在常温下,下列五种溶液:
①0.1mol/L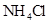 ?②0.1mol/L
?②0.1mol/L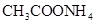 ?③0.1mol/L
?③0.1mol/L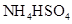
④0.1mol/L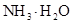 和0.1mol/L
和0.1mol/L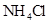 混合液?⑤0.1mol/L
混合液?⑤0.1mol/L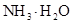
请根据要求填写下列空白:
(1)溶液①呈?性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中,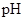 最小的是?;
最小的是?; 最小的是?(填序号)
最小的是?(填序号)
(3)比较溶液②、③中 的大小关系是②?③(填“>”、“<”或“=”)。
的大小关系是②?③(填“>”、“<”或“=”)。
(4)在溶液④中,?离子的浓度为0.1mol/L;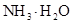 和?离子的物质的量浓度之和为0.2mol/L。
和?离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的 ,则说明
,则说明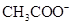 的水解程度?(填“>”、“<”或“="”" )
的水解程度?(填“>”、“<”或“="”" )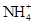 的水解程度,
的水解程度,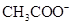 与
与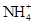 浓度的大小关系是:
浓度的大小关系是:
?? (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
参考答案:(1)、酸(1分)、 NH4+ +H2O  NH3·H2O+ H+(3分);
NH3·H2O+ H+(3分);
(2)、③(1分),⑤(1分);?(3)、<(1分);(4)、Cl-(1分), NH4+(1分);
(5)、 =(1分), =(1分)
本题解析:(1)氯化铵是强酸弱碱盐,水解显酸性,方程式为NH4+ +H2O  NH3·H2O+ H+。
NH3·H2O+ H+。
(2)磷酸氢铵能电离出氢离子,酸性最强。氨水是弱电解质,存在电离平衡,所以⑤中 最小。
最小。
(3)硫酸氢钠显酸性,能抑制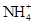 的水解,所以③大于②。
的水解,所以③大于②。
(4)氯离子不水解,所以氯离子浓度是0.1mol/L。根据原子守恒可知,NH3·H2O和NH4+的浓度之和是0.2molL。
(5)常温下,测得溶液②的 ,则说明
,则说明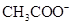 的水解程度等于
的水解程度等于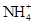 的水解程度,所以
的水解程度,所以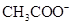 与
与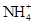 浓度相等。
浓度相等。
本题难度:一般
2、选择题 25℃时,amol/L稀盐酸与bmoL/L稀氢氧化钠溶液等体积混合后,所得溶液的pH=12(混合液的总体积可视为原两种溶液体积相加),则a和b的关系为(?)。
A.a=b/2
B.b=a+0.02
C.a=b+0.02
D. a=b+0.01
参考答案:B
本题解析:所得溶液的pH=12,即:[OH-]=1.0×10-2mol·L-1;
HCl+NaOH=NaCl+H2O
1? 1
aV? aV
[OH-]=(bV- aV)moL/2VL=1.0×10-2mol·L-1,得:b=a+0.02
本题难度:一般
3、填空题 (4分)水的电离平衡如图所示.
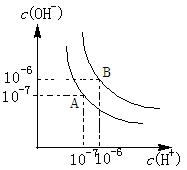
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为?
(2)将100℃时p H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为?
H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为? ?
?
参考答案:
本题解析:略
本题难度:一般
4、选择题 用pH试纸测定某氨基酸溶液的pH,如果将pH试纸用水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=8。则此氨基酸溶液的实际pH?
A.大于8
B.小于8
C.等于8
D.小于7
参考答案:A
本题解析:pH试纸用水润湿后,测得pH=8,相当于把溶液稀释了,所以在稀释之前碱性应该更强,所以PH>8,选A。
本题难度:简单
5、填空题 已知下列热化学方程式:?
①2H2(g) +O2(g)=2H2O(l)? ΔH=" -" 570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g)? ΔH=" -" 483.6 kJ·mol-1?
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)? ΔH= --114.6kJ·mol-1?
回答下列问题:
H2的燃烧热为?;反应③的中和热为?。
参考答案:(1)285 kJ·mol-1;57.3kJ·mol-1
本题解析:略
本题难度:简单