微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。

(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是_______________。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求__________________________。
(3)写出反应④生成沉淀X的离子方程式:________________________?。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:_____________________________。
(5)生成Li2CO3的化学反应方程式为___________________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______________。
参考答案:(1)增大接触面积,加快反应速率
(2)隔绝空气和水分
(3)CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–
(4)4LiMn2O4+2H2SO4+O2=8MnO2+2?Li2SO4+2H2O
(5)Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤
本题解析:
本题难度:一般
2、填空题 铝是一种重要的金属,在生产、生活中具有许多重要的用途。眉山市电解铝厂位于三苏故里修文乡,现已经形成年产33万吨电解铝,配套年产15万吨阳级碳块的规模。该厂用铝土矿为原料制备铝的工艺流程如下

已知:
①铝土矿的主要成分是?Al2O3,此外还含有少量CuO、Fe2O3等杂质。?
②电解冶炼铝时用碳棒作阳极,用Na3AlF6作助熔剂,电解熔融的Al2O3。
回答下列问题:?
(1)写出铝土矿与?A?溶液反应的化学方程式?________________。
(2)滤渣?C的主要成分为___________;实验室过滤时使用的玻璃仪器有___________。
(3)生成过程中,除CaO、H2O可以循环使用外,还可以循环使用的物质有________?(填化学式)。
(4)写出过量CO2通入滤液C生成D的离子方程式?___________________。
(5)若生产54吨铝,放出平均摩尔质量为36g/mol的气体(经测定气体中不含O2),则消耗阳极______吨。
参考答案:(1)Al2O3+2NaOH=2NaAlO2+H2O
(2)CuO、Fe2O3;烧杯、漏斗、玻璃棒
(3)CaCO3、CO2、NaOH?
(4)CO2+AlO2-+2H2O?=?Al(OH)3↓+HCO3-
(5)24
本题解析:
本题难度:一般
3、选择题 下列各组物质中属铝热剂的是
[? ]
A.Al? Cr2O3
B.Al2O3? Fe
C.Al? MgO
D.Mn? Al2O3
参考答案:A
本题解析:
本题难度:简单
4、填空题 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为 8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16O2 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__________(填元素符号)。
(2?)上述冶炼过程产生大量SO2。下列处理方案中合理的是_______(填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3? d.用浓硫酸吸收
(3?)过二硫酸钾(K2S2O8)具有强氧化性可将I-氧化为I2:S2O82-+2I-=2SO42-+I2 通过改变反应途径,Fe3+、Fe2+?均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。______________?、______________。(不必配平)
(4?)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO?、SiO2、Al2O3)可制备Fe2O3。方法为①?用稀盐酸浸取炉渣,过滤。
②?滤液先氧化,再加入过量NaOH?溶液过滤,将沉淀洗涤、干澡、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________?。
b.选用提供的试剂设计实验验证炉渣中含有Fe2O3。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水所选试剂为______________。证明炉渣中含有FeO?的实验现象为_____________________。
参考答案:(1)Cu、O
(2)b、c
(3)2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=SO42-+2Fe3+
(4)a.Al3++4OH-=AlO2-+2H2O。[或Al3++4OH-=Al(OH)4-]
b.稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
本题解析:
本题难度:一般
5、填空题 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式____________, 属于弱酸的电离方程式________________________________。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是_______________(选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为_____________________________________。
(4)Na2CO3俗称纯碱,属于_________晶体。工业上制取纯碱的原料是_________________________。
参考答案:(1)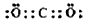 ;
;
(2)ac
(3)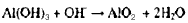
(4)离子晶体;二氧化碳、氯化钠、氨
本题解析:
本题难度:一般